Page 182 - Libro Hipertextos Quimica 1
P. 182
El agua y las soluciones
Solubilidad 1.3 Solubilidad
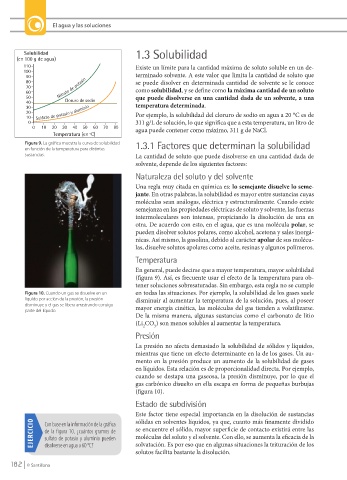
(en 100 g de agua)
110 Existe un límite para la cantidad máxima de soluto soluble en un de-
100
90 terminado solvente. A este valor que limita la cantidad de soluto que
80 se puede disolver en determinada cantidad de solvente se le conoce
70 Nitrato de potasio
60 como solubilidad, y se define como la máxima cantidad de un soluto
50 que puede disolverse en una cantidad dada de un solvente, a una
40 Cloruro de sodio
30 temperatura determinada.
20 Sulfato de potasio y aluminio Por ejemplo, la solubilidad del cloruro de sodio en agua a 20 °C es de
10
0 311 g/L de solución, lo que significa que a esta temperatura, un litro de
0 10 20 30 40 50 60 70 80 agua puede contener como máximo, 311 g de NaCl.
Temperatura (en ºC)
Figura 9. La gráfica muestra la curva de solubilidad 1.3.1 Factores que determinan la solubilidad
en función de la temperatura para distintas
sustancias. La cantidad de soluto que puede disolverse en una cantidad dada de
solvente, depende de los siguientes factores:
Naturaleza del soluto y del solvente
Una regla muy citada en química es: lo semejante disuelve lo seme-
jante. En otras palabras, la solubilidad es mayor entre sustancias cuyas
moléculas sean análogas, eléctrica y estructuralmente. Cuando existe
semejanza en las propiedades eléctricas de soluto y solvente, las fuerzas
intermoleculares son intensas, propiciando la disolución de una en
otra. De acuerdo con esto, en el agua, que es una molécula polar, se
pueden disolver solutos polares, como alcohol, acetona y sales inorgá-
nicas. Así mismo, la gasolina, debido al carácter apolar de sus molécu-
las, disuelve solutos apolares como aceite, resinas y algunos polímeros.
Temperatura
En general, puede decirse que a mayor temperatura, mayor solubilidad
(figura 9). Así, es frecuente usar el efecto de la temperatura para ob-
tener soluciones sobresaturadas. Sin embargo, esta regla no se cumple
Figura 10. Cuando un gas se disuelve en un en todas las situaciones. Por ejemplo, la solubilidad de los gases suele
líquido por acción de la presión, la presión disminuir al aumentar la temperatura de la solución, pues, al poseer
disminuye y el gas se libera arrastrando consigo mayor energía cinética, las moléculas del gas tienden a volatilizarse.
parte del líquido.
De la misma manera, algunas sustancias como el carbonato de litio
(Li CO ) son menos solubles al aumentar la temperatura.
2
3
Presión
La presión no afecta demasiado la solubilidad de sólidos y líquidos,
mientras que tiene un efecto determinante en la de los gases. Un au-
mento en la presión produce un aumento de la solubilidad de gases
en líquidos. Esta relación es de proporcionalidad directa. Por ejemplo,
cuando se destapa una gaseosa, la presión disminuye, por lo que el
gas carbónico disuelto en ella escapa en forma de pequeñas burbujas
(figura 10).
Estado de subdivisión
Este factor tiene especial importancia en la disolución de sustancias
sólidas en solventes líquidos, ya que, cuanto más finamente dividido
EJERCICIO Con base en la información de la gráfica se encuentre el sólido, mayor superficie de contacto existirá entre las
de la figura 10, ¿cuántos gramos de
moléculas del soluto y el solvente. Con ello, se aumenta la eficacia de la
sulfato de potasio y aluminio pueden
solvatación. Es por eso que en algunas situaciones la trituración de los
disolverse en agua a 60 °C?
solutos facilita bastante la disolución.
182 © Santillana
QUIM10-U5(176-203).indd 182 1/12/09 14:19