Page 79 - Libro Hipertextos Quimica 1
P. 79
Componente: Procesos físicos
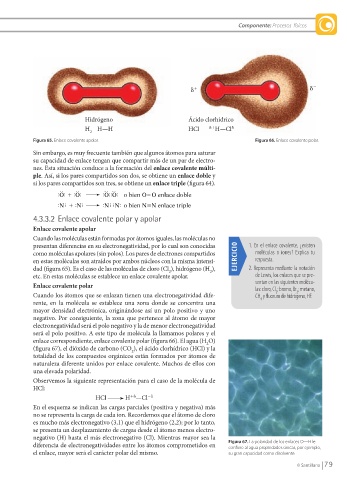
Hidrógeno Ácido clorhídrico
H H—H HCl H—Cl
2
Figura 65. Enlace covalente apolar. Figura 66. Enlace covalente polar.
Sin embargo, es muy frecuente también que algunos átomos para saturar
su capacidad de enlace tengan que compartir más de un par de electro-
nes. Esta situación conduce a la formación del enlace covalente múlti-
ple. Así, si los pares compartidos son dos, se obtiene un enlace doble y
si los pares compartidos son tres, se obtiene un enlace triple (fi gura 64).
:O: :O: :O::O: o bien O O enlace doble
:
:
:
:
:N :N :N N: o bien N N enlace triple
4.3.3.2 Enlace covalente polar y apolar
Enlace covalente apolar
Cuando las moléculas están formadas por átomos iguales, las moléculas no
presentan diferencias en su electronegatividad, por lo cual son conocidas 1. En el enlace covalente, ¿existen
como moléculas apolares (sin polos). Los pares de electrones compartidos EJERCICIO moléculas o iones? Explica tu
en estas moléculas son atraídos por ambos núcleos con la misma intensi- respuesta.
dad (fi gura 65). Es el caso de las moléculas de cloro (Cl ), hidrógeno (H ), 2. Representa mediante la notación
2 2
etc. En estas moléculas se establece un enlace covalente apolar. de Lewis, los enlaces que se pre-
sentan en las siguientes molécu-
Enlace covalente polar
las: cloro, Cl ; bromo, Br ; metano,
2
2
Cuando los átomos que se enlazan tienen una electronegatividad dife- CH y fl uoruro de hidrógeno, HF.
4
rente, en la molécula se establece una zona donde se concentra una
mayor densidad electrónica, originándose así un polo positivo y uno
negativo. Por consiguiente, la zona que pertenece al átomo de mayor
electronegatividad será el polo negativo y la de menor electronegatividad
será el polo positivo. A este tipo de molécula la llamamos polares y el
enlace correspondiente, enlace covalente polar (fi gura 66). El agua (H O)
2
(fi gura 67), el dióxido de carbono (CO ), el ácido clorhídrico (HCl) y la
2
totalidad de los compuestos orgánicos están formados por átomos de
naturaleza diferente unidos por enlace covalente. Muchos de ellos con
una elevada polaridad.
Observemos la siguiente representación para el caso de la molécula de
HCl:
HCl H —Cl
En el esquema se indican las cargas parciales (positiva y negativa) más
no se representa la carga de cada ion. Recordemos que el átomo de cloro
es mucho más electronegativo (3,1) que el hidrógeno (2,2); por lo tanto,
se presenta un desplazamiento de cargas desde el átomo menos electro-
negativo (H) hasta el más electronegativo (Cl). Mientras mayor sea la
Figura 67. La polaridad de los enlaces O—H le
diferencia de electronegatividades entre los átomos comprometidos en confi ere al agua propiedades únicas, por ejemplo,
el enlace, mayor será el carácter polar del mismo. su gran capacidad como disolvente.
© Santillana 79
QUIM10-U2(72-95).indd 79 1/12/09 17:58