Page 75 - Libro Hipertextos Quimica 1
P. 75
Componente: Procesos físicos
En el proceso de formación de un enlace se desprende energía; de la mis-
ma forma, se requiere del suministro de una cantidad de energía igual E
o superior a la desprendida en la formación del enlace para separar los
átomos que formaron el enlace. Podemos decir entonces, que la energía
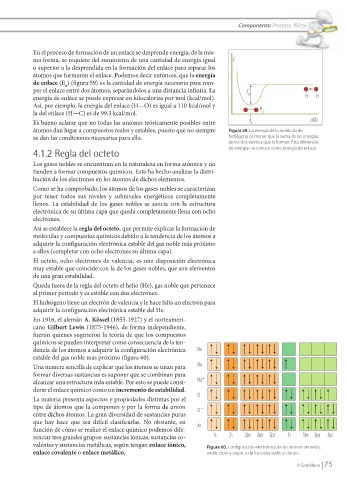
de enlace (E ) (fi gura 59) es la cantidad de energía necesaria para rom-
e
per el enlace entre dos átomos, separándolos a una distancia infi nita. La E p
energía de enlace se puede expresar en kilocalorías por mol (kcal/mol). H H
Así, por ejemplo, la energía del enlace (H—O) es igual a 110 kcal/mol y
H
la del enlace (H—C) es de 99,3 kcal/mol. 2
d d(Å)
Es bueno aclarar que no todas las uniones teóricamente posibles entre e
átomos dan lugar a compuestos reales y estables, puesto que no siempre Figura 59. La energía de la molécula de
se dan las condiciones necesarias para ello. hidrógeno es menor que la suma de las energías
de los dos átomos que la forman. Esta diferencia
de energías se conoce como energía de enlace.
4.1.2 Regla del octeto
Los gases nobles se encuentran en la naturaleza en forma atómica y no
tienden a formar compuestos químicos. Esto ha hecho analizar la distri-
bución de los electrones en los átomos de dichos elementos.
Como se ha comprobado, los átomos de los gases nobles se caracterizan
por tener todos sus niveles y subniveles energéticos completamente
llenos. La estabilidad de los gases nobles se asocia con la estructura
electrónica de su última capa que queda completamente llena con ocho
electrones.
Así se establece la regla del octeto, que permite explicar la formación de
moléculas y compuestos químicos debido a la tendencia de los átomos a
adquirir la confi guración electrónica estable del gas noble más próximo
a ellos (completar con ocho electrones su última capa).
El octeto, ocho electrones de valencia, es una disposición electrónica
muy estable que coincide con la de los gases nobles, que son elementos
de una gran estabilidad.
Queda fuera de la regla del octeto el helio (He), gas noble que pertenece
al primer período y es estable con dos electrones.
El hidrógeno tiene un electrón de valencia y le hace falta un electrón para
adquirir la confi guración electrónica estable del He.
En 1916, el alemán A. Kössel (1853-1927) y el norteameri-
cano Gilbert Lewis (1875-1946), de forma independiente,
fueron quienes sugirieron la teoría de que los compuestos
químicos se pueden interpretar como consecuencia de la ten-
dencia de los átomos a adquirir la confi guración electrónica Ne
estable del gas noble más próximo (fi gura 60).
Na
Una manera sencilla de explicar que los átomos se unan para
formar diversas sustancias es suponer que se combinan para
alcanzar una estructura más estable. Por esto se puede consi- Na
derar el enlace químico como un incremento de estabilidad.
Cl
La materia presenta aspectos y propiedades distintas por el
tipo de átomos que la componen y por la forma de unión
Cl
entre dichos átomos. La gran diversidad de sustancias puras
que hay hace que sea difícil clasifi carlas. No obstante, en
Ar
función de cómo se realice el enlace químico podemos dife-
renciar tres grandes grupos: sustancias iónicas, sustancias co- 1s 2s 2px 2py 2pz 3s 3px 3py 3pz
valentes y sustancias metálicas, según tengan enlace iónico, Figura 60. Confi guración electrónica de los átomos de neón,
enlace covalente o enlace metálico. sodio, cloro y argón, y de los iones sodio y cloruro.
© Santillana 75
QUIM10-U2(72-95).indd 75 1/12/09 17:58