Page 734 - Quimica - Undécima Edición
P. 734
704 CAPÍTULO 15 Ácidos y bases
15.11 Propiedades ácido-base de los óxidos
y los hidróxidos
Como vimos en el capítulo 8, los óxidos se clasifi can como ácidos, básicos o anfóteros.
Por lo tanto, un estudio de las reacciones ácido-base sin examinar las propiedades de
estos compuestos quedaría incompleto.
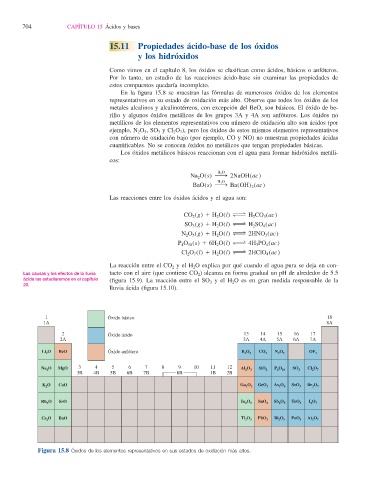
En la fi gura 15.8 se muestran las fórmulas de numerosos óxidos de los elementos
representativos en su estado de oxidación más alto. Observe que todos los óxidos de los
metales alcalinos y alcalinotérreos, con excepción del BeO, son básicos. El óxido de be-
rilio y algunos óxidos metálicos de los grupos 3A y 4A son anfóteros. Los óxido s no
metálicos de los elementos representativos con número de oxidación alto son ácidos (por
ejemplo, N 2 O 5 , SO 3 y Cl 2 O 7 ), pero los óxidos de estos mismos elementos representativos
con número de oxidación bajo (por ejemplo, CO y NO) no muestran propiedades ácidas
cuantifi cables. No se conocen óxidos no metálicos que tengan propiedades básicas.
Los óxidos metálicos básicos reaccionan con el agua para formar hidróxidos metáli-
cos :
H 2 O
N a 2 O(s) ¡ 2NaOH(ac)
H 2 O
B a O (s) ¡ Ba(OH) 2 (ac)
Las reacciones entre los óxidos ácidos y el agua son:
C O 2 (g) 1 H 2 O(l) Δ H 2 CO 3 (ac)
S O 3 (g) 1 H 2 O(l) Δ H 2 SO 4 (ac)
N 2 O 5 (g) 1 H 2 O(l) Δ 2HNO 3 (ac)
P 4 O 10 (s) 1 6H 2 O(l) Δ 4H 3 PO 4 (ac)
l C 2 O 7 (l) 1 H 2 O(l) Δ 2HClO 4 (ac)
La reacción entre el CO 2 y el H 2 O explica por qué cuando el agua pura se deja en con-
Las causas y los efectos de la lluvia tacto con el aire (que contiene CO 2 ) alcanza en forma gradual un pH de alrededor de 5.5
ácida las estudiaremos en el capítulo (fi gura 15.9). La reacción entre el SO 3 y el H 2 O es en gran medida responsable de la
20.
lluvia ácida (fi gura 15.10).
1 Óxido básico 18
1A 8A
2 Óxido ácido 13 14 15 16 17
2A 3A 4A 5A 6A 7A
Li O BeO Óxido anfótero B O 3 CO 2 N O 5 OF 2
2
2
2
Na O MgO 3 4 5 6 7 8 9 10 11 12 Al O 3 SiO 2 P O 10 SO 3 Cl O 7
4
2
2
2
3B 4B 5B 6B 7B 8B 1B 2B
K O CaO Ga O GeO As O SeO Br O
2 2 3 2 2 5 3 2 7
Rb 2 O SrO In O 3 SnO 2 Sb O 5 TeO 3 I O 7
2
2
2
Cs 2 O BaO Tl O PbO Bi O PoO At O
2 3 2 2 5 3 2 7
Figura 15.8 Óxidos de los elementos representativos en sus estados de oxidación más altos.