Page 685 - Quimica - Undécima Edición
P. 685
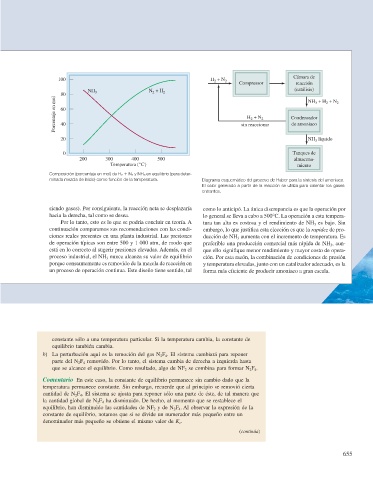
Cámara de
100 H 2 + N 2
Compressor reacción
NH N + H (catálisis)
80 3 2 2 NH + H + N 2
Porcentaje en mol 60 sin reaccionar Condensador
3
2
+ N
2
H 2
40
de amoniaco
20 NH líquido
3
0 Tanques de
200 300 400 500 almacena-
Temperatura (°C) miento
Composición (porcentaje en mol) de H 2 1 N 2 y NH 3 en equilibrio (para deter-
minada mezcla de inicio) como función de la temperatura. Diagrama esquemático del proceso de Haber para la síntesis del amoniaco.
El calor generado a partir de la reacción se utiliza para calentar los gases
entrantes.
siendo gases). Por consiguiente, la reacción neta se desplazaría como lo anticipó. La única discrepancia es que la operación por
hacia la derecha, tal como se desea. lo general se lleva a cabo a 500°C. La operación a esta tempera-
Por lo tanto, esto es lo que se podría concluir en teoría. A tura tan alta es costosa y el rendimiento de NH 3 es bajo. Sin
continuación comparamos sus recomendaciones con las condi- embargo, lo que justifi ca esta elección es que la rapidez de pro-
ciones reales presentes en una planta industrial. Las presiones ducción de NH 3 aumenta con el incremento de temperatura. Es
de operación típicas son entre 500 y 1 000 atm, de modo que preferible una producción comercial más rápida de NH 3 , aun-
está en lo correcto al sugerir presiones elevadas. Además, en el que ello signifi que menor rendimiento y mayor costo de opera-
proceso industrial, el NH 3 nunca alcanza su valor de equilibrio ción. Por esta razón, la combinación de condiciones de presión
porque constantemente es removido de la mezcla de reacción en y temperatura elevadas, junto con un catalizador adecuado, es la
un proceso de operación continua. Este diseño tiene sentido, tal forma más efi ciente de producir amoniaco a gran escala.
constante sólo a una temperatura particular. Si la temperatura cambia, la constante de
equilibrio también cambia.
b) La perturbación aquí es la remoción del gas N 2 F 4 . El sistema cambiará para reponer
parte del N 2 F 4 removido. Por lo tanto, el sistema cambia de derecha a izquierda hasta
que se alcance el equilibrio. Como resultado, algo de NF 2 se combina para formar N 2 F 4 .
Comentario En este caso, la constante de equilibrio permanece sin cambio dado que la
temperatura permanece constante. Sin embargo, recuerde que al principio se removió cierta
cantidad de N 2 F 4 . El sistema se ajusta para reponer sólo una parte de éste, de tal manera que
la cantidad global de N 2 F 4 ha disminuido. De hecho, al momento que se restablece el
equilibrio, han disminuido las cantidades de NF 2 y de N 2 F 4 . Al observar la expresión de la
constante de equilibrio, notamos que si se divide un numerador más pequeño entre un
denominador más pequeño se obtiene el mismo valor de K c .
(continúa)
655