Page 684 - Quimica - Undécima Edición
P. 684
QUÍMICA
en acción
El proceso Haber
onocer los factores que alteran el equilibrio químico tiene
100
Cun gran valor práctico en los procesos industriales, como el
de la síntesis de amoniaco . El proceso Haber para sintetizar este
compuesto, a partir de hidrógeno y nitrógeno moleculares, utili- 80
za un catalizador heterogéneo para acelerar la reacción (vea la
página 603). A continuación analizaremos la reacción en equili- 60
brio para la síntesis de amoniaco con el fi n de determinar qué Porcentaje molar del NH 3
factores se podrían manipular para aumentar el rendimiento. 40
Suponga que, como un destacado químico industrial a
principios del siglo xxi, se le pide que diseñe un procedimiento 20
efi ciente para sintetizar amoniaco a partir de hidrógeno y nitró-
geno. Su objetivo principal es obtener un alto rendimiento de
0
producto a un bajo costo de producción. El primer paso es exa- 1 000 2 000 3 000 4 000
minar con cuidado la ecuación balanceada para la producción Presión (atm)
de amoniaco:
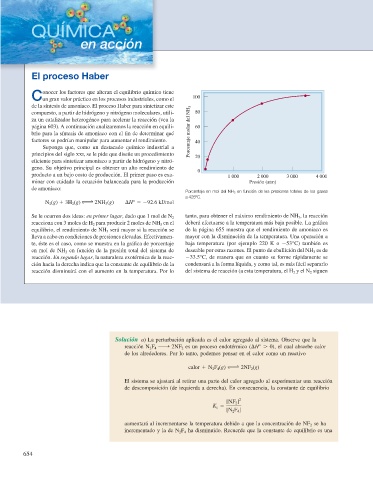
Porcentaje en mol del NH 3 en función de las presiones totales de los gases
a 425ºC.
N 2 (g) 1 3H 2 (g) Δ 2NH 3 (g) DH° 5 292.6 kJ/mol
Se le ocurren dos ideas: en primer lugar, dado que 1 mol de N 2 tanto, para obtener el máximo rendimiento de NH 3 , la reacción
reacciona con 3 moles de H 2 para producir 2 moles de NH 3 en el deberá efectuarse a la temperatura más baja posible. La gráfi ca
equilibrio, el rendimiento de NH 3 será mayor si la reacción se de la página 655 muestra que el rendimiento de amoniaco es
lleva a cabo en condiciones de presiones elevadas. Efectivamen- mayor con la disminución de la temperatura. Una operación a
te, éste es el caso, como se muestra en la gráfi ca de porcentaje baja temperatura (por ejemplo 220 K o 253°C) también es
en mol de NH 3 en función de la presión total del sistema de deseable por otras razones. El punto de ebullición del NH 3 es de
reacción. En segundo lugar, la naturaleza exotérmica de la reac- 233.5°C, de manera que en cuanto se forme rápidamente se
ción hacia la derecha indica que la constante de equilibrio de la condensará a la forma líquida, y como tal, es más fácil separarlo
reacción disminuirá con el aumento en la temperatura. Por lo del sistema de reacción (a esta temperatura, el H 2 y el N 2 siguen
Solución a) La perturbación aplicada es el calor agregado al sistema. Observe que la
reacción N 2 F 4 ¡ 2NF 2 es un proceso endotérmico (DH° . 0), el cual absorbe calor
de los alrededores. Por lo tanto, podemos pensar en el calor como un reactivo
calor 1 N 2 F 4 (g) Δ 2NF 2 (g)
El sistema se ajustará al retirar una parte del calor agregado al experimentar una reacción
de descomposición (de izquierda a derecha). En consecuencia, la constante de equilibrio
[NF 2 ] 2
K c 5
[N 2 F 4 ]
aumentará al incrementarse la temperatura debido a que la concentración de NF 2 se ha
incrementado y la de N 2 F 4 ha disminuido. Recuerde que la constante de equilibrio es una
654