Page 431 - Quimica - Undécima Edición
P. 431
9.10 Entalpía de enlace 401
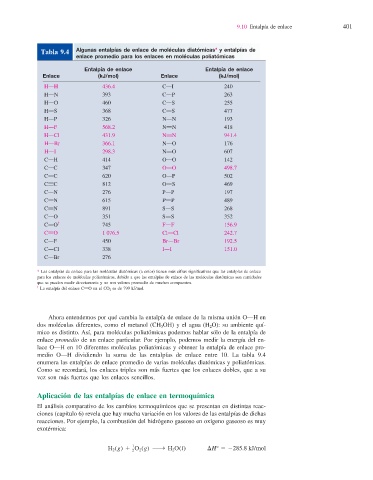
Algunas entalpías de enlace de moléculas diatómicas* y entalpías de
Tabla 9.4
enlace promedio para los enlaces en moléculas poliatómicas
Entalpía de enlace Entalpía de enlace
Enlace (kJ/mol) Enlace (kJ/mol)
HOH 436.4 COI 240
HON 393 COP 263
HOO 460 COS 255
HOS 368 CPS 477
HOP 326 NON 193
HOF 568.2 NPN 418
HOCl 431.9 NqN 941.4
HOBr 366.1 NOO 176
HOI 298.3 NPO 607
COH 414 OOO 142
COC 347 OPO 498.7
CPC 620 OOP 502
CqC 812 OPS 469
CON 276 POP 197
CPN 615 PPP 489
CqN 891 SOS 268
COO 351 SPS 352
CPO † 745 FOF 156.9
CqO 1 076.5 ClOCl 242.7
COF 450 BrOBr 192.5
COCl 338 IOI 151.0
COBr 276
* Las entalpías de enlace para las moléculas diatómicas (a color) tienen más cifras signifi cativas que las entalpías de enlace
para los enlaces de moléculas poliatómicas , debido a que las entalpías de enlace de las moléculas diatómicas son cantidades
que se pueden medir directamente y no son valores promedio de muchos compuestos.
† —
La entalpía del enlace C—O en el CO 2 es de 799 kJ/mol.
Ahora entendemos por qué cambia la entalpía de enlace de la misma unión O—H en
dos moléculas diferentes, como el metanol (CH 3 OH) y el agua (H 2 O) : su ambiente quí-
mico es distinto. Así, para moléculas poliatómicas podemos hablar sólo de la entalpía de
enlace promedio de un enlace particular. Por ejemplo, podemos medir la energía del en-
lace O—H en 10 diferentes moléculas poliatómicas y obtener la entalpía de enlace pro-
medio O—H dividiendo la suma de las entalpías de enlace entre 10. La tabla 9.4
enumera las entalpías de enlace promedio de varias moléculas diatómicas y poliatómicas.
Como se recordará, los enlaces triples son más fuertes que los enlaces dobles, que a su
vez son más fuertes que los enlaces sencillos.
Aplicación de las entalpías de enlace en termoquímica
El análisis comparativo de los cambios termoquímicos que se presentan en distintas reac-
ciones (capítulo 6) revela que hay mucha variación en los valores de las entalpías de dichas
reacciones. Por ejemplo, la combustión del hidrógeno gaseoso en oxígeno gaseoso es muy
exotérmica:
1
H 2 (g) 1 O 2 (g) ¡ H 2 O(l) ¢H° 52285.8 kJ/mol
2