Page 16 - Libro Hipertextos Quimica 2
P. 16
Conceptos previos
y p p
p p p p p
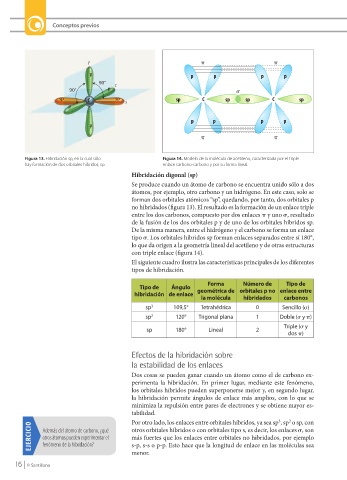
90° z
90° p s
sp C sp x sp C sp sp C sp
p
p p p p
p
p p
Figura 13. Hibridación sp, en la cual sólo Figura 14. Modelo de la molécula de acetileno, caracterizada por el triple
hay formación de dos orbitales híbridos, sp. enlace carbono-carbono y por su forma líneal.
Hibridación digonal (sp)
Se produce cuando un átomo de carbono se encuentra unido sólo a dos
átomos, por ejemplo, otro carbono y un hidrógeno. En este caso, solo se
forman dos orbitales atómicos “sp”, quedando, por tanto, dos orbitales p
no hibridados (figura 13). El resultado es la formación de un enlace triple
entre los dos carbonos, compuesto por dos enlaces p y uno s, resultado
de la fusión de los dos orbitales p y de uno de los orbitales híbridos sp.
De la misma manera, entre el hidrógeno y el carbono se forma un enlace
tipo s. Los orbitales híbridos sp forman enlaces separados entre sí 180°,
lo que da origen a la geometría lineal del acetileno y de otras estructuras
con triple enlace (figura 14).
El siguiente cuadro ilustra las características principales de los diferentes
tipos de hibridación.
Forma Número de Tipo de
Tipo de Ángulo
hibridación de enlace geométrica de orbitales p no enlace entre
la molécula hibridados carbonos
sp 3 109,5° Tetrahédrica 0 Sencillo (s)
sp 2 120° Trigonal plana 1 Doble (s y p)
Triple (s y
sp 180° Lineal 2
dos p)
Efectos de la hibridación sobre
la estabilidad de los enlaces
Dos cosas se pueden ganar cuando un átomo como el de carbono ex-
perimenta la hibridación. En primer lugar, mediante este fenómeno,
los orbitales híbridos pueden superponerse mejor y, en segundo lugar,
la hibridación permite ángulos de enlace más amplios, con lo que se
minimiza la repulsión entre pares de electrones y se obtiene mayor es-
tabilidad.
3
2
Por otro lado, los enlaces entre orbitales híbridos, ya sea sp , sp o sp, con
EJERCICIO Además del átomo de carbono, ¿qué otros orbitales híbridos o con orbitales tipo s, es decir, los enlaces s, son
más fuertes que los enlaces entre orbitales no hibridados, por ejemplo
otros átomos pueden experimentar el
s-p, s-s o p-p. Esto hace que la longitud de enlace en las moléculas sea
fenómeno de la hibridación?
menor.
16 © Santillana
QUIM11-U1(6-31).indd 16 22/12/09 9:50