Page 15 - Libro Hipertextos Quimica 2
P. 15
Componente: Procesos físicos
Igualmente, este tipo de estructura molecular se puede presentar
cuando el carbono se combina con otros átomos de carbono o de
elementos divalentes, como el oxígeno o trivalentes, como el nitró-
geno: sp 3
H
•• H •• •• H •• •• 109,5°
H •• C C H •• Cl C H H •• C O H H •• C N H
••
H H ••••
••
••
••
••
••
••
••
••
•• •• •• •• •• •• •• ••
H H H H H H
sp 3 C
CH —CH CH Cl CH OH CH —NH 2
3
3
3
3
3
En los casos expuestos anteriormente se presenta una hibridación sp 3
de tipo tetragonal, tal como puede observarse en la figura 11. Los sp 3
orbitales sp y los enlaces que de ellos resultan, así como los núcleos
3
positivos de todos los átomos unidos al carbono están lo más lejos
posible entre sí y para conseguir esto se ubican con ángulos de en- p
lace de 109,5°. Figura 11. La ilustración muestra un modelo
3
de la hibridación tetragonal, sp , del carbono, con
La idea de que las moléculas en las cuales el carbono se comporta lo cual el átomo adquiere una forma tetrahédrica.
90°
2
sp
como tetravalente presentan una conformación tridimensional te-
traédrica fue propuesta, por primera vez en 1874, por Jacobus Van´t sp 2
Hoff y Joseph Le Bel, quienes afirmaron que la orientación de los 120°
orbitales híbridos no era al azar sino regular. sp 2
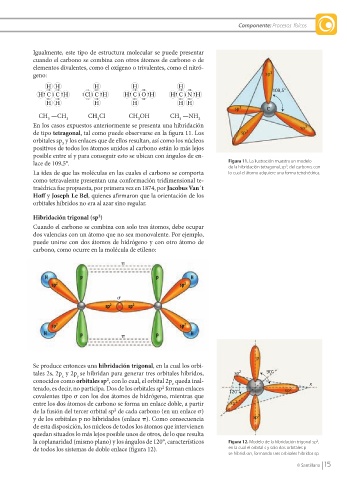
Hibridación trigonal (sp ) sp 2
2
Cuando el carbono se combina con solo tres átomos, debe ocupar
dos valencias con un átomo que no sea monovalente. Por ejemplo,
puede unirse con dos átomos de hidrógeno y con otro átomo de
carbono, como ocurre en la molécula de etileno:
p
sp 3
H p p H
sp 2 sp 2
109,5°
s
sp 2 sp 2 sp 3 C
sp 2 sp 2 sp 3
H p p p H sp 3
p
Se produce entonces una hibridación trigonal, en la cual los orbi-
tales 2s, 2p y 2p se hibridan para generar tres orbitales híbridos, sp 2 90°
x
y
conocidos como orbitales sp , con lo cual, el orbital 2p queda inal- x
2
z
2
terado, es decir, no participa. Dos de los orbitales sp forman enlaces 120° sp 2
covalentes tipo s con los dos átomos de hidrógeno, mientras que
entre los dos átomos de carbono se forma un enlace doble, a partir sp 2
2
de la fusión del tercer orbital sp de cada carbono (en un enlace s)
y de los orbitales p no hibridados (enlace p). Como consecuencia sp 2
de esta disposición, los núcleos de todos los átomos que intervienen
quedan situados lo más lejos posible unos de otros, de lo que resulta
la coplanaridad (mismo plano) y los ángulos de 120°, característicos Figura 12. Modelo de la hibridación trigonal sp ,
2
de todos los sistemas de doble enlace (figura 12). en la cual el orbital s y solo dos orbitales p
se hibridizan, formando tres orbitales híbridos sp.
© Santillana 15
QUIM11-U1(6-31).indd 15 22/12/09 9:50