Page 407 - Quimica - Undécima Edición
P. 407
9.3 Energía reticular de los compuestos iónicos 377
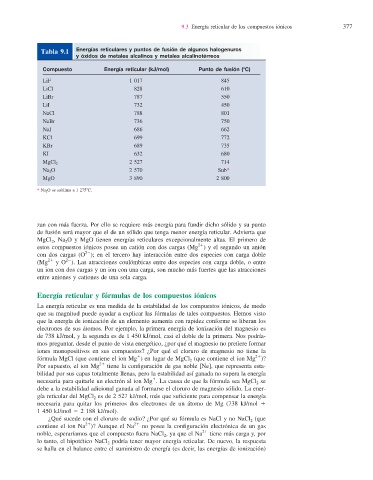
Energías reticulares y puntos de fusión de algunos halogenuros
Tabla 9.1
y óxidos de metales alcalinos y metales alcalinotérreos
Compuesto Energía reticular (kJ/mol) Punto de fusión (8C)
LiF 1 017 845
LiCl 828 610
LiBr 787 550
LiI 732 450
NaCl 788 801
NaBr 736 750
NaI 686 662
KCl 699 772
KBr 689 735
KI 632 680
2 527 714
MgCl 2
Na 2 O 2 570 Sub*
MgO 3 890 2 800
* Na 2 O se sublima a 1 2758C.
zan con más fuerza. Por ello se requiere más energía para fundir dicho sólido y su punto
de fusión será mayor que el de un sólido que tenga menor energía reticular . Advierta que
MgCl 2 , Na 2 O y MgO tienen energías reticulares excepcionalmente altas. El primero de
21
estos compuestos iónicos posee un catión con dos cargas (Mg ) y el segundo un anión
22
con dos cargas (O ); en el tercero hay interacción entre dos especies con carga doble
21
22
(Mg y O ). Las atracciones coulómbicas entre dos especies con carga doble , o entre
un ion con dos cargas y un ion con una carga, son mucho más fuertes que las atracciones
entre aniones y cationes de una sola carga.
Energía reticular y fórmulas de los compuestos iónicos
La energía reticular es una medida de la estabilidad de los compuestos iónicos , de modo
que su magnitud puede ayudar a explicar las fórmulas de tales compuestos. Hemos visto
que la energía de ionización de un elemento aumenta con rapidez conforme se liberan los
electrones de sus átomos. Por ejemplo, la primera energía de ionización del magnesio es
de 738 kJ/mol, y la segunda es de 1 450 kJ/mol, casi el doble de la primera. Nos podría-
mos preguntar, desde el punto de vista energético, ¿por qué el magnesio no prefi ere formar
iones monopositivos en sus compuestos? ¿Por qué el cloruro de magnesio no tiene la
21
1
fórmula MgCl (que contiene el ion Mg ) en lugar de MgCl 2 (que contiene el ion Mg )?
21
Por supuesto, el ion Mg tiene la confi guración de gas noble [Ne], que representa esta-
bilidad por sus capas totalmente llenas, pero la estabilidad así ganada no supera la energía
1
necesaria para quitarle un electrón al ion Mg . La causa de que la fórmula sea MgCl 2 se
debe a la estabilidad adicional ganada al formarse el cloruro de magnesio sólido . La ener-
gía reticular del MgCl 2 es de 2 527 kJ/mol, más que sufi ciente para compensar la energía
necesaria para quitar los primeros dos electrones de un átomo de Mg (738 kJ/mol 1
1 450 kJ/mol 5 2 188 kJ/mol).
¿Qué sucede con el cloruro de sodio? ¿Por qué su fórmula es NaCl y no NaCl 2 (que
21
21
contiene el ion Na )? Aunque el Na no posee la confi guración electrónica de un gas
21
noble, esperaríamos que el compuesto fuera NaCl 2 , ya que el Na tiene más carga y, por
lo tanto, el hipotético NaCl 2 podría tener mayor energía reticular. De nuevo, la respuesta
se halla en el balance entre el suministro de energía (es decir, las energías de ionización )