Page 218 - Libro Hipertextos Quimica 1
P. 218
Equilibrio químico
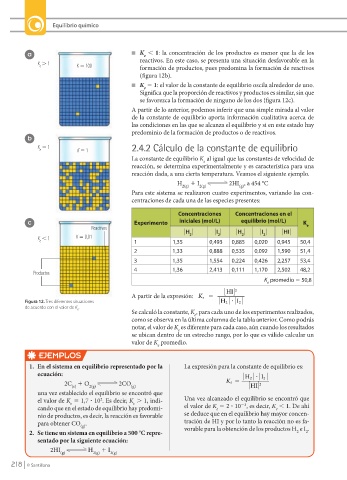
a n K , 1: la concentración de los productos es menor que la de los
e
reactivos. En este caso, se presenta una situación desfavorable en la
K . 1 K 5 100 formación de productos, pues predomina la formación de reactivos
e
(figura 12b).
n K 5 1: el valor de la constante de equilibrio oscila alrededor de uno.
e
Significa que la proporción de reactivos y productos es similar, sin que
se favorezca la formación de ninguno de los dos (figura 12c).
A partir de lo anterior, podemos inferir que una simple mirada al valor
de la constante de equilibrio aporta información cualitativa acerca de
las condiciones en las que se alcanza el equilibrio y si en este estado hay
predominio de la formación de productos o de reactivos.
b
K 5 1 K 5 1 2.4.2 Cálculo de la constante de equilibrio
e
La constante de equilibrio K al igual que las constantes de velocidad de
e
reacción, se determina experimentalmente y es característica para una
reacción dada, a una cierta temperatura. Veamos el siguiente ejemplo.
H 1 I 2HI , a 454 °C
2(g) 2(g) (g)
Para este sistema se realizaron cuatro experimentos, variando las con-
centraciones de cada una de las especies presentes:
Concentraciones Concentraciones en el
c Experimento iniciales (mol/L) equilibrio (mol/L) K
Reactivos 3H 4 3I 4 3H 4 3I 4 3HI4 e
K , 1 K 5 0,01 2 2 2 2
e 1 1,35 0,493 0,885 0,020 0,945 50,4
2 1,33 0,888 0,535 0,092 1,590 51,4
3 1,35 1,554 0,224 0,426 2,257 53,4
4 1,36 2,413 0,111 1,170 2,502 48,2
Productos
K promedio 5 50,8
e
HI 2
A partir de la expresión: K e
Figura 12. Tres diferentes situaciones H 2
I 2
de acuerdo con el valor de K . e
Se calculó la constante, K , para cada uno de los experimentos realizados,
e
como se observa en la última columna de la tabla anterior. Como podrás
notar, el valor de K es diferente para cada caso, aún cuando los resultados
e
se ubican dentro de un estrecho rango, por lo que es válido calcular un
valor de K promedio.
e
EJEMPLOS
1. En el sistema en equilibrio representado por la La expresión para la constante de equilibrio es:
ecuación: H 2
I 2
2C 1 O 2CO K e 2
(s) 2(g) (g) HI
una vez establecido el equilibrio se encontró que
el valor de K 5 1,7 ? 10 . Es decir, K . 1, indi- Una vez alcanzado el equilibrio se encontró que
2
e
e
23
cando que en el estado de equilibrio hay predomi- el valor de K 5 2 ? 10 , es decir, K , 1. De ahí
e
e
nio de productos, es decir, la reacción es favorable se deduce que en el equilibrio hay mayor concen-
para obtener CO . tración de HI y por lo tanto la reacción no es fa-
(g)
2
2
2. Se tiene un sistema en equilibrio a 500 °C repre- vorable para la obtención de los productos H e I .
sentado por la siguiente ecuación:
2HI H 1 I
(g) 2(g) 2(g)
218 © Santillana
QUIM10-U6(208-229).indd 218 1/12/09 18:16