Page 216 - Libro Hipertextos Quimica 1
P. 216
MANEJO CONOCIMIENTOS
PROPIOS DE LAS CIENCIAS NATURALES
2. Equilibrio químico
El segundo aspecto importante por tratar dentro de la ci-
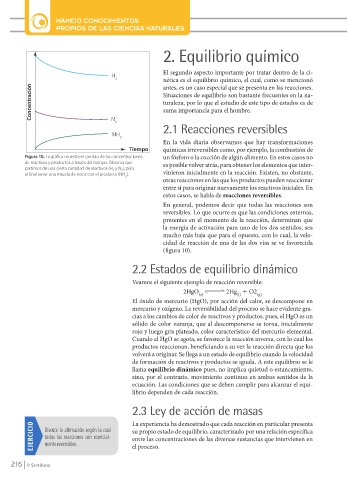
H 2 nética es el equilibrio químico, el cual, como se mencionó
antes, es un caso especial que se presenta en las reacciones.
Concentración Situaciones de equilibrio son bastante frecuentes en la na-
turaleza, por lo que el estudio de este tipo de estados es de
suma importancia para el hombre.
N
2
2.1 Reacciones reversibles
NH
3
En la vida diaria observamos que hay transformaciones
Tiempo químicas irreversibles como, por ejemplo, la combustión de
Figura 10. La gráfica muestra el cambio de las concentraciones un fósforo o la cocción de algún alimento. En estos casos no
de reactivos y productos a través del tiempo. Observa que es posible volver atrás, para obtener los elementos que inter-
partimos de una cierta cantidad de reactivos (H y N ), para
2
2
al final tener una mezcla de éstos con el producto (NH ). vinieron inicialmente en la reacción. Existen, no obstante,
3
otras reacciones en las que los productos pueden reaccionar
entre sí para originar nuevamente los reactivos iniciales. En
estos casos, se habla de reacciones reversibles.
En general, podemos decir que todas las reacciones son
reversibles. Lo que ocurre es que las condiciones externas,
presentes en el momento de la reacción, determinan que
la energía de activación para uno de los dos sentidos, sea
mucho más baja que para el opuesto, con lo cual, la velo-
cidad de reacción de una de las dos vías se ve favorecida
(figura 10).
2.2 Estados de equilibrio dinámico
Veamos el siguiente ejemplo de reacción reversible:
2HgO 2Hg 1 O2 (g)
(l)
(s)
El óxido de mercurio (HgO), por acción del calor, se descompone en
mercurio y oxígeno. La reversibilidad del proceso se hace evidente gra-
cias a los cambios de color de reactivos y productos, pues, el HgO es un
sólido de color naranja, que al descomponerse se torna, inicialmente
rojo y luego gris plateado, color característico del mercurio elemental.
Cuando el HgO se agota, se favorece la reacción inversa, con lo cual los
productos reaccionan, beneficiando a su vez la reacción directa que los
volverá a originar. Se llega a un estado de equilibrio cuando la velocidad
de formación de reactivos y productos se iguala. A este equilibrio se le
llama equilibrio dinámico pues, no implica quietud o estancamiento,
sino, por el contrario, movimiento continuo en ambos sentidos de la
ecuación. Las condiciones que se deben cumplir para alcanzar el equi-
librio dependen de cada reacción.
2.3 Ley de acción de masas
EJERCICIO Discute la afirmación según la cual La experiencia ha demostrado que cada reacción en particular presenta
su propio estado de equilibrio, caracterizado por una relación específica
todas las reacciones son esencial-
entre las concentraciones de las diversas sustancias que intervienen en
mente reversibles.
el proceso.
216 © Santillana
QUIM10-U6(208-229).indd 216 1/12/09 18:16