Page 217 - Libro Hipertextos Quimica 1
P. 217
Componente: Procesos físicos
Estas observaciones fueron la base para la formulación de la ley de 100
acción de masas, la cual se enuncia en los siguientes términos: la velo-
cidad de una reacción química es proporcional al producto de las masas 75 SO 3
activas de las sustancias reaccionantes. La expresión masas activas hace
referencia a las concentraciones de las sustancias que participan en la 50
reacción. Recordemos que esta ley es la base para la formulación de la Concentración (%) Concentraciones
ecuación de velocidad. Cuando se presenta un estado de equilibrio, la SO 2 en el equilibrio
ley de acción de masas relaciona las velocidades en los sentidos, directo 25 O 2
(reactivos a productos) e inverso (productos a reactivos), como se verá
a continuación. 0 Tiempo
a) Se parte de los reactivos para obtener el producto.
2.4 La constante de equilibrio 100
Examinemos la reacción: 75 SO 3
H 2(g) 1 I 2(g) 2HI (g)
Las expresiones de velocidad para cada dirección son: 50
v 5 K ? 3H 4 3I 4 v 5 K ? 3HI4 2 Concentración (%) SO 2 Concentraciones
1 1 2 2 2 2 en el equilibrio
Según lo expuesto hasta ahora, en el equilibrio, las dos velocidades son 25 O 2
iguales. Es decir:
v 5 v 2 0 Tiempo
1
De donde obtenemos la igualdad: K ? 3H 4 ? 3I 4 5 K ? 3HI4 2 b) Se parte del producto para obtener los reactivos.
1 2 2 2
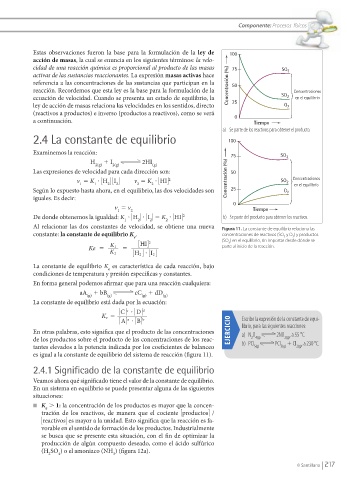
Al relacionar las dos constantes de velocidad, se obtiene una nueva Figura 11. La constante de equilibrio relaciona las
constante: la constante de equilibrio K . concentraciones de reactivos (SO y O ) y productos
e 2 2
HI 2 (SO ) en el equilibrio, sin importar desde dónde se
3
Ke K 1 parte al inicio de la reacción.
K 2 H 2
I 2
La constante de equilibrio K es característica de cada reacción, bajo
e
condiciones de temperatura y presión específi cas y constantes.
En forma general podemos afi rmar que para una reacción cualquiera:
aA 1 bB cC 1 dD (g)
(g)
(g)
(g)
La constante de equilibrio está dada por la ecuación:
C
c D d
K e
A
a B b Escribe la expresión de la constante de equi-
librio, para las siguientes reacciones:
En otras palabras, esto signifi ca que el producto de las concentraciones EJERCICIO a) N O 2NO , a 55 °C.
de los productos sobre el producto de las concentraciones de los reac- 2 4(g) 2(g)
tantes elevados a la potencia indicada por los coefi cientes de balanceo b) PCl PCl 1 Cl , a 230 °C.
2(g)
5(g)
3(g)
es igual a la constante de equilibrio del sistema de reacción (fi gura 11).
2.4.1 Signifi cado de la constante de equilibrio
Veamos ahora qué signifi cado tiene el valor de la constante de equilibrio.
En un sistema en equilibrio se puede presentar alguna de las siguientes
situaciones:
n K . 1: la concentración de los productos es mayor que la concen-
e
tración de los reactivos, de manera que el cociente 3productos4 /
3reactivos4 es mayor a la unidad. Esto signifi ca que la reacción es fa-
vorable en el sentido de formación de los productos. Industrialmente
se busca que se presente esta situación, con el fi n de optimizar la
producción de algún compuesto deseado, como el ácido sulfúrico
(H SO ) o el amoniaco (NH ) (fi gura 12a).
3
4
2
© Santillana 217
QUIM10-U6(208-229).indd 217 1/12/09 18:16