Page 78 - Quimica - Undécima Edición
P. 78
48 CAPÍTULO 2 Átomos, moléculas y iones
2.4 La tabla periódica
Más de la mitad de los elementos que se conocen en la actualidad se descubrieron entre
1800 y 1900. Durante este periodo los químicos observaron que muchos elementos mos-
traban grandes semejanzas entre ellos. El reconocimiento de las regularidades periódicas
en las propiedades físicas y en el comportamiento químico, así como la necesidad de
organizar la gran cantidad de información disponible sobre la estructura y propiedades
de las sustancias elementales, condujeron al desarrollo de la tabla periódica , una tabla en
la que se encuentran agrupados los elementos que tienen propiedades químicas y físicas
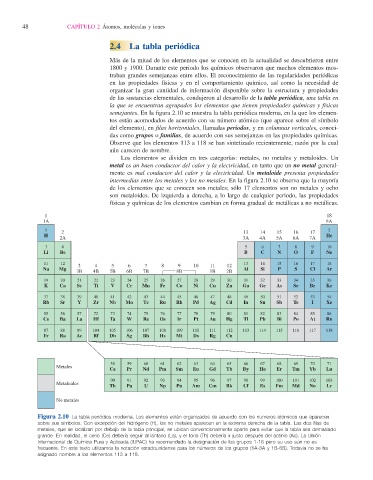
semejantes. En la fi gura 2.10 se muestra la tabla periódica moderna , en la que los elemen-
tos están acomodados de acuerdo con su número atómico (que aparece sobre el símbolo
del elemento), en fi las horizontales, llamadas periodos , y en columnas verticales, conoci-
das como grupos o familias , de acuerdo con sus semejanzas en las propiedades químicas.
Observe que los elementos 113 a 118 se han sintetizado recientemente, razón por la cual
aún carecen de nombre.
Los elementos se dividen en tres categorías: metales, no metales y metaloides. Un
metal es un buen conductor del calor y la electricidad, en tanto que un no metal general-
mente es mal conductor del calor y la electricidad. Un metaloide presenta propiedades
intermedias entre los metales y los no metales. En la fi gura 2.10 se observa que la mayoría
de los elementos que se conocen son metales; sólo 17 elementos son no metales y ocho
son metaloides. De izquierda a derecha, a lo largo de cualquier periodo, las propiedades
físicas y químicas de los elementos cambian en forma gradual de metálicas a no metálicas.
1 18
1A 8A
1 2 13 14 15 16 17 2
H He
2A 3A 4A 5A 6A 7A
3 4 5 6 7 8 9 10
Li Be B C N O F Ne
11 12 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
Na Mg Al Si P S Cl Ar
3B 4B 5B 6B 7B 8B 1B 2B
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
55 56 57 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
87 88 89 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118
Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg Cn
58 59 60 61 62 63 64 65 66 67 68 69 70 71
Metales
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
90 91 92 93 94 95 96 97 98 99 100 101 102 103
Metaloides
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
No metales
Figura 2.10 La tabla periódica moderna. Los elementos están organizados de acuerdo con los números atómicos que aparecen
sobre sus símbolos. Con excepción del hidrógeno (H), los no metales aparecen en la extrema derecha de la tabla. Las dos fi las de
metales, que se localizan por debajo de la tabla principal, se ubican convencionalmente aparte para evitar que la tabla sea demasiado
grande. En realidad, el cerio (Ce) debería seguir al lantano (La), y el torio (Th) debería ir justo después del actinio (Ac). La Unión
Internacional de Química Pura y Aplicada (IUPAC) ha recomendado la designación de los grupos 1-18 pero su uso aún no es
frecuente. En este texto utilizamos la notación estadounidense para los números de los grupos (1A-8A y 1B-8B). Todavía no se ha
asignado nombre a los elementos 113 a 118.