Page 464 - Quimica - Undécima Edición
P. 464
434 CAPÍTULO 10 Enlace químico II: Geometría molecular e hibridación de orbitales atómicos
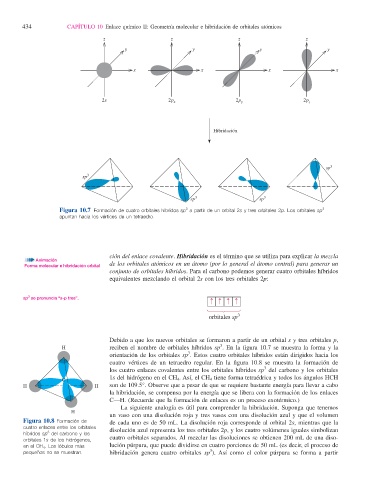
z z z z
y y y y
x x x x
2s 2p x 2p y 2p z
Hibridación
sp 3
sp 3
sp 3 sp 3
3
3
Figura 10.7 Formación de cuatro orbitales híbridos sp a partir de un orbital 2s y tres orbitales 2p. Los orbitales sp
apuntan hacia los vértices de un tetraedro.
ción del enlace covalente. Hibridación es el término que se utiliza para explicar la mezcla
Animación
Forma molecular e hibridación orbital de los orbitales atómicos en un átomo (por lo general el átomo central) para generar un
conjunto de orbitales híbridos . Para el carbono podemos generar cuatro orbitales híbridos
equivalentes mezclando el orbital 2s con los tres orbitales 2p:
3
sp se pronuncia “s-p tres”.
h h h h
orbitales sp 3
Debido a que los nuevos orbitales se formaron a partir de un orbital s y tres orbitales p,
3
H reciben el nombre de orbitales híbridos sp . En la fi gura 10.7 se muestra la forma y la
3
orientación de los orbitales sp . Estos cuatro orbitales híbridos están dirigidos hacia los
cuatro vértices de un tetraedro regular. En la fi gura 10.8 se muestra la formación de
3
los cuatro enlaces covalentes entre los orbitales híbridos sp del carbono y los orbitales
1s del hidrógeno en el CH 4 . Así, el CH 4 tiene forma tetraédrica y todos los ángulos HCH
C
H H son de 109.5°. Observe que a pesar de que se requiere bastante energía para llevar a cabo
la hibridación, se compensa por la energía que se libera con la formación de los enlaces
C—H. (Recuerde que la formación de enlaces es un proceso exotérmico.)
La siguiente analogía es útil para comprender la hibridación. Suponga que tenemos
H
un vaso con una disolución roja y tres vasos con una disolución azul y que el volumen
Figura 10.8 Formación de de cada uno es de 50 mL. La disolución roja corresponde al orbital 2s, mientras que la
cuatro enlaces entre los orbitales disolución azul representa los tres orbitales 2p, y los cuatro volúmenes iguales simbolizan
3
híbridos sp del carbono y los
orbitales 1s de los hidrógenos, cuatro orbitales separados. Al mezclar las disoluciones se obtienen 200 mL de una diso-
en el CH 4 . Los lóbulos más lución púrpura, que puede dividirse en cuatro porciones de 50 mL (es decir, el proceso de
3
pequeños no se muestran. hibridación genera cuatro orbitales sp ). Así como el color púrpura se forma a partir