Page 413 - Quimica - Undécima Edición
P. 413
9.5 Electronegatividad 383
Aumento de la electronegatividad
1A 8A
H
2.1 2A 3A 4A 5A 6A 7A
Li
N
B
C
Be
O
F
Aumento de la electronegatividad Na Mg 3B 4B Nb Mo Mn Ru Co Ni Cu Zn Ga Ge 2.1 2.5 Cl Kr
4.0
3.5
2.0
2.5
3.0
1.0
1.5
P
S
Al
Si
5B
6B
1.2
0.9
2B
1B
8B
3.0
1.8
1.5
7B
Se
As
Br
K
Cr
Sc
Fe
Ti
V
Ca
1.5
1.8
1.0
2.0
2.8
1.3
1.5
1.8
1.6
1.6
1.9
3.0
1.6
1.6
2.4
1.9
1.9
0.8
Sb
Sn
Pd
Ag
Cd
Tc
In
Rh
Te
Zr
Y
Sr
I
Rb
Xe
1.7
1.7
2.2
1.0
2.2
2.2
2.5
0.8
2.6
1.8
1.4
1.6
1.9
1.9
1.9
2.1
1.8
1.2
Cs
Ba
Ir
2.0
1.9
1.9
1.9
2.2
1.8
1.7
1.3
1.9
1.0-1.2
2.2
0.7
2.4
0.9
1.5
2.2
Fr Ra La-Lu Hf Ta W Re Os 2.2 Pt Au Hg Tl Pb Bi Po At
0.7 0.9
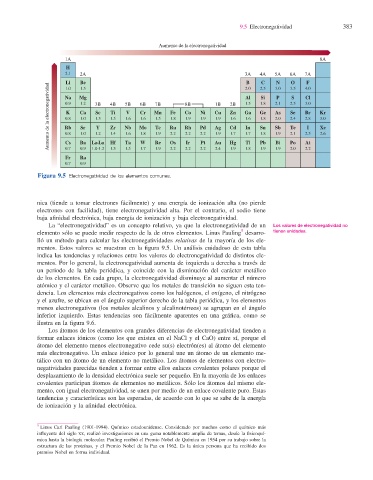
Figura 9.5 Electronegatividad de los elementos comunes.
nica (tiende a tomar electrones fácilmente) y una energía de ionización alta (no pierde
electrones con facilidad), tiene electronegatividad alta. Por el contrario, el sodio tiene
baja afi nidad electrónica, baja energía de ionización y baja electronegatividad.
La “electronegatividad” es un concepto relativo, ya que la electronegatividad de un Los valores de electronegatividad no
5
elemento sólo se puede medir respecto de la de otros elementos. Linus Pauling desarro- tienen unidades.
lló un método para calcular las electronegatividades relativas de la mayoría de los ele-
mentos. Estos valores se muestran en la fi gura 9.5. Un análisis cuidadoso de esta tabla
indica las tendencias y relaciones entre los valores de electronegatividad de distintos ele-
mentos. Por lo general, la electronegatividad aumenta de izquierda a derecha a través de
un periodo de la tabla periódica, y coincide con la disminución del carácter metálico
de los elementos. En cada grupo, la electronegatividad disminuye al aumentar el número
atómico y el carácter metálico. Observe que los metales de transición no siguen esta ten-
dencia. Los elementos más electronegativos como los halógenos, el oxígeno, el nitrógeno
y el azufre, se ubican en el ángulo superior derecho de la tabla periódica, y los elementos
menos electronegativos (los metales alcalinos y alcalinotérreos) se agrupan en el ángulo
inferior izquierdo. Estas tendencias son fácilmente aparentes en una gráfi ca, como se
ilustra en la fi gura 9.6.
Los átomos de los elementos con grandes diferencias de electronegatividad tienden a
formar enlaces iónicos (como los que existen en el NaCl y el CaO) entre sí, porque el
átomo del elemento menos electronegativo cede su(s) electrón(es) al átomo del elemento
más electronegativo. Un enlace iónico por lo general une un átomo de un elemento me-
tálico con un átomo de un elemento no metálico. Los átomos de elementos con electro-
negatividades parecidas tienden a formar entre ellos enlaces covalentes polares porque el
desplazamiento de la densidad electrónica suele ser pequeño. En la mayoría de los enlaces
covalentes participan átomos de elementos no metálicos. Sólo los átomos del mismo ele-
mento, con igual electronegatividad, se unen por medio de un enlace covalente puro . Estas
tendencias y características son las esperadas, de acuerdo con lo que se sabe de la energía
de ionización y la afi nidad electrónica.
5
Linus Carl Pauling (1901-1994). Químico estadounidense. Considerado por muchos como el químico más
infl uyente del siglo xx, realizó investigaciones en una gama notablemente amplia de temas, desde la fi sicoquí-
mica hasta la biología molecular. Pauling recibió el Premio Nobel de Química en 1954 por su trabajo sobre la
estructura de las proteínas, y el Premio Nobel de la Paz en 1962. Es la única persona que ha recibido dos
premios Nobel en forma individual.