Page 315 - Quimica - Undécima Edición
P. 315
7.3 Teoría de Bohr del átomo de hidrógeno 285
Placa fotográfica
Rendija
Alto
voltaje
Espectro
Prisma de líneas
Tubo de descarga
Luz separada en
sus componentes
a)
400 nm 500 600 700
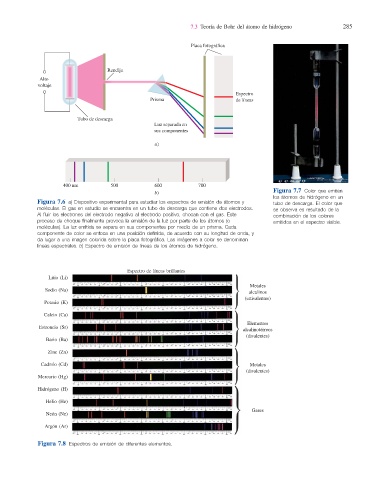
b) Figura 7.7 Color que emiten
los átomos de hidrógeno en un
Figura 7.6 a) Dispositivo experimental para estudiar los espectros de emisión de átomos y tubo de descarga. El color que
moléculas. El gas en estudio se encuentra en un tubo de descarga que contiene dos electrodos. se observa es resultado de la
Al fl uir los electrones del electrodo negativo al electrodo positivo, chocan con el gas. Este combinación de los colores
proceso de choque fi nalmente provoca la emisión de la luz por parte de los átomos (o emitidos en el espectro visible.
moléculas). La luz emitida se separa en sus componentes por medio de un prisma. Cada
componente de color se enfoca en una posición defi nida, de acuerdo con su longitud de onda, y
da lugar a una imagen colorida sobre la placa fotográfi ca. Las imágenes a color se denominan
líneas espectrales. b) Espectro de emisión de líneas de los átomos de hidrógeno.
Espectro de líneas brillantes
Litio (Li)
Metales
Sodio (Na)
alcalinos
(univalentes)
Potasio (K)
Calcio (Ca)
Elementos
Estroncio (Sr)
alcalinotérreos
(divalentes)
Bario (Ba)
Zinc (Zn)
Cadmio (Cd) Metales
(divalentes)
Mercurio (Hg)
Hidrógeno (H)
Helio (He)
Gases
Neón (Ne)
Argón (Ar)
Figura 7.8 Espectros de emisión de diferentes elementos.