Page 318 - Quimica - Undécima Edición
P. 318
288 CAPÍTULO 7 Teoría cuántica y la estructura electrónica de los átomos
∞
7
6
5
4
Serie de
Brackett
3
Serie de
Paschen
Energía 2 Serie de
Balmer
n = 1
Serie de
Lyman
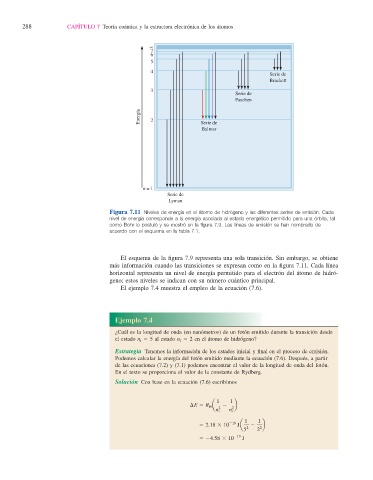
Figura 7.11 Niveles de energía en el átomo de hidrógeno y las diferentes series de emisión. Cada
nivel de energía corresponde a la energía asociada al estado energético permitido para una órbita, tal
como Bohr lo postuló y se mostró en la fi gura 7.9. Las líneas de emisión se han nombrado de
acuerdo con el esquema en la tabla 7.1.
El esquema de la fi gura 7.9 representa una sola transición. Sin embargo, se obtiene
más información cuando las transiciones se expresan como en la fi gura 7.11. Cada línea
horizontal representa un nivel de energía permitido para el electrón del átomo de hidró-
geno; estos niveles se indican con su número cuántico principal.
El ejemplo 7.4 muestra el empleo de la ecuación (7.6).
Ejemplo 7.4
¿Cuál es la longitud de onda (en nanómetros) de un fotón emitido durante la transición desde
el estado n i 5 5 al estado n f 5 2 en el átomo de hidrógeno?
Estrategia Tenemos la información de los estados inicial y fi nal en el proceso de emisión.
Podemos calcular la energía del fotón emitido mediante la ecuación (7.6). Después, a partir
de las ecuaciones (7.2) y (7.1) podemos encontrar el valor de la longitud de onda del fotón.
En el texto se proporciona el valor de la constante de Rydberg.
Solución Con base en la ecuación (7.6) escribimos
¢E 5 R H a 1 2 1 b
2 2
n i n f
1 1
5 2.18 3 10 218 J a 2 b
5 2 2 2
219
524.58 3 10 J