Page 237 - Fisica General Burbano
P. 237
248 ESTUDIO BÁSICO DE LA ESTRUCTURA DE LA MATERIA. MECÁNICA DE FLUIDOS
ción F (que las representamos como negativas), ambas en función de la distan-
a
cia que las separa, obteniéndose la representación gráfica adjunta. Cuando las
partículas (átomos o moléculas) se encuentran en equilibrio, entonces r =r Þ
0
F (r) =0.Si r <r Þ F (r) >0, y la fuerza de enlace entre las dos partículas es
0
de repulsión y crece rápidamente al disminuir la distancia, lo que nos explica la
práctica incompresibilidad de los sólidos y líquidos. Por último, si
r >r Þ F (r) <0, y la fuerza entre las dos partículas es de atracción, que nos
0
explican la resistencia a ser separadas las partículas que estructuran macroscópi-
camente una sustancia, observándose que más allá de una cierta distancia son
despreciables. La energía de enlace entre dos partículas U (r), que representamos
en el gráfico de la Fig. XII-2B, es mínima para r =r lo que naturalmente corres-
0
ponde a la posición de equilibrio.
En toda sustancia en equilibrio, formando una estructura macroscópica, las
partículas que rodean a una cualquiera se encuentran en su mayor parte (excep-
tuamos a la que se encuentran a la distancia r ) a distancias r >r interaccionando
0
0
entre sí por las fuerzas de atracción que llamamos de COHESIÓN. Naturalmente, en
el interior de la sustancia en equilibrio, cada partícula atrae y es atraída por todas
las que le rodean, las acciones iguales en todas las direcciones y sentidos se equi-
libran. Las fuerzas de cohesión en líquidos y entre sólidos y líquidos producen los
llamados fenómenos moleculares y de superficie que se estudian en el capítulo
XIII.
Las fuerzas electromagnéticas causantes de los enlaces, las podemos clasificar
en dos tipos: las culombianas y las de intercambio, interviniendo ambas en una
relación variable y según la configuración eléctrica de los átomos y moléculas
que intervienen.
Decimos que existe entre los átomos un ENLACE IÓNICO o HETEROPOLAR cuando
las fuerzas que intervienen son mayoritariamente culombianas (Ej. de la unión de
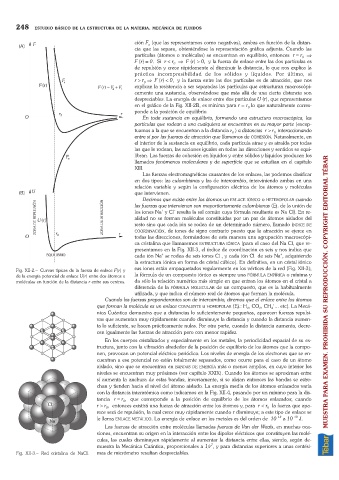
los iones Na y Cl resulta la sal común cuya fórmula resultante es Na Cl). En re-
+
alidad no se forman moléculas constituidas por un par de átomos aislados del
resto sino que cada ión se rodea de un determinado número, llamado ÍNDICE DE
COORDINACIÓN, de iones de signo contrario puesto que la atracción se ejerce en
todas las direcciones, formándose de esta manera una agrupación macroscópi-
ca cristalina que llamaremos ESTRUCTURA IÓNICA (para el caso del Na Cl, que re-
presentamos en la Fig. XII-3, el índice de coordinación es seis y nos indica que
cada ión Na se rodea de seis iones Cl , y cada ión Cl de seis Na , adquiriendo
+
+
la estructura iónica en forma de cristal cúbico). En definitiva, en un cristal iónico
Fig. XII-2. Curvas típicas de la fuerza de enlace F(r) y sus iones están empaquetados regularmente en los vértices de la red (Fig. XII-3);
de la energía potencial de enlace U(r) entre dos átomos o la fórmula de un compuesto iónico es siempre una FÓRMULA EMPÍRICA o mínima y
moléculas en función de la distancia r entre sus centros. da sólo la relación numérica más simple en que entran los átomos en el cristal a
diferencia de la FÓRMULA MOLECULAR de un compuesto, que es la habitualmente
utilizada, y que indica el número real de átomos que forman la molécula. MUESTRA PARA EXAMEN. PROHIBIDA SU REPRODUCCIÓN. COPYRIGHT EDITORIAL TÉBAR
Cuando las fuerzas preponderantes son de intercambio, diremos que el enlace entre los átomos
que forman la molécula es un enlace COVALENTE u HOMOPOLAR (Ej.: H , CO , CH ... etc). La Mecá-
+
2
2
4
nica Cuántica demuestra que a distancias lo suficientemente pequeñas, aparecen fuerzas repulsi-
vas que aumentan muy rápidamente cuando disminuye la distancia y cuando la distancia aumen-
ta lo suficiente, se hacen prácticamente nulas. Por otra parte, cuando la distancia aumenta, decre-
cen igualmente las fuerzas de atracción pero con menor rapidez.
En los cuerpos cristalizados y especialmente en los metales, la periodicidad espacial de su es-
tructura, junto con la vibración alrededor de la posición de equilibrio de los átomos que la compo-
nen, provocan un potencial eléctrico periódico. Los niveles de energía de los electrones que se en-
cuentran a ese potencial no están totalmente separados, como ocurre para el caso de un átomo
aislado, sino que se encuentran en BANDAS DE ENERGÍA más o menos amplias, en cuyo interior los
niveles se encuentran muy próximos (ver capítulo XXIX). Cuando los átomos se aproximan entre
sí aumenta la anchura de estas bandas; inversamente, si se alejan entonces las bandas se estre-
chan y tienden hacia el nivel del átomo aislado. La energía media de los átomos enlazados varía
con la distancia interatómica como indicamos en la Fig. XII-4, pasando por un mínimo para la dis-
tancia r =r , que corresponde a la posición de equilibrio de los átomos enlazados; cuando
0
r >r , entonces existirá una fuerza de atracción entre los átomos y, para r <r la fuerza que apa-
0
0
rece será de repulsión, la cual crece muy rápidamente cuando r disminuye; a este tipo de enlace se
le llama ENLACE METÁLICO. La energía de enlace en los metales es del orden de 10 18 a 10 19 J.
Las fuerzas de atracción entre moléculas llamadas fuerzas de Van der Waals, en muchas oca-
siones, encuentran su origen en la interacción entre los dipolos eléctricos que constituyen las molé-
culas, las cuales disminuyen rápidamente al aumentar la distancia entre ellas, siendo, según de-
muestra la Mecánica Cuántica, proporcionales a 1/r , y para distancias superiores a unas centési-
7
Fig. XII-3. Red cristalina de NaCl. mas de micrómetro resultan despreciables.