Page 149 - Libro Hipertextos Quimica 1
P. 149
Componente: Procesos físicos
n El volumen ocupado por un gas depende de la presión ejercida sobre
éste, de forma que poseen una alta compresibilidad (fi gura 2).
n Debido a que las fuerzas entre las partículas de un gas son débiles,
éstas se hallan dispersas en el espacio. Como resultado de esto, el vo-
lumen que ocupa un gas es muy superior al volumen de las partículas
constitutivas del mismo, pues estas presentan una baja densidad.
n Cuando dos o más gases se hallan ocupando el mismo espacio, sus
partículas se entremezclan completa y uniformemente, por lo que se
dice que los gases poseen una alta miscibilidad.
Algunas sustancias que se presentan en estado gaseoso, a temperatura
ambiente son: el nitrógeno (N ), el oxígeno (O ), el hidrógeno (H ), el
2
2
2
dióxido de carbono (CO ) y el cloro (Cl ). El oxígeno y el hidrógeno son Figura 2. Los gases se expanden
2
2
los elementos constitutivos del agua, sin la cual no hubiera sido posible y comprimen con gran facilidad.
el desarrollo de la gran variedad de seres vivos que habita el planeta
Tierra. Por esta razón, vamos a dedicar los siguientes apartados al estu-
dio de estos dos gases.
1.2.1 El oxígeno
1.2.1.1 Historia
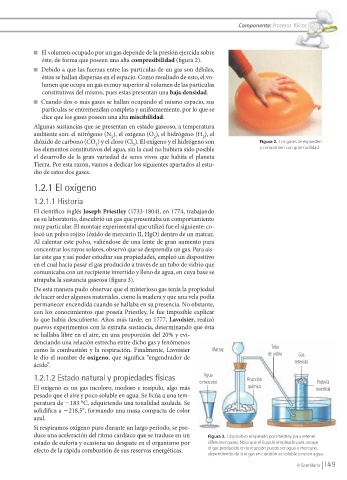
El científi co inglés Joseph Priestley (1733-1804), en 1774, trabajando
en su laboratorio, descubrió un gas que presentaba un comportamiento
muy particular. El montaje experimental que utilizó fue el siguiente: co-
locó un polvo rojizo (óxido de mercurio II, HgO) dentro de un matraz.
Al calentar este polvo, valiéndose de una lente de gran aumento para
concentrar los rayos solares, observó que se desprendía un gas. Para ais-
lar este gas y así poder estudiar sus propiedades, empleó un dispositivo
en el cual hacía pasar el gas producido a través de un tubo de vidrio que
comunicaba con un recipiente invertido y lleno de agua, en cuya base se
atrapaba la sustancia gaseosa (fi gura 3).
De esta manera pudo observar que el misterioso gas tenía la propiedad
de hacer arder algunos materiales, como la madera y que una vela podía
permanecer encendida cuando se hallaba en su presencia. No obstante,
con los conocimientos que poseía Priestley, le fue imposible explicar
lo que había descubierto. Años más tarde, en 1777, Lavoisier, realizó
nuevos experimentos con la extraña sustancia, determinando que ésta
se hallaba libre en el aire, en una proporción del 20% y evi-
denciando una relación estrecha entre dicho gas y fenómenos
Tubo
como la combustión y la respiración. Finalmente, Lavoisier Matraz de vidrio
le dio el nombre de oxígeno, que signifi ca “engendrador de Gas
ácido”. retenido
Agua
1.2.1.2 Estado natural y propiedades físicas o mercurio Reacción Probeta
El oxígeno es un gas incoloro, inodoro e insípido, algo más química invertida
pesado que el aire y poco soluble en agua. Se licúa a una tem-
peratura de 2183 °C, adquiriendo una tonalidad azulada. Se
solidifi ca a 2218,5°, formando una masa compacta de color
azul.
Si respiramos oxígeno puro durante un largo período, se pro-
duce una aceleración del ritmo cardiaco que se traduce en un Figura 3. Dispositivo empleado por Priestley para retener
estado de euforia y ocasiona un desgaste en el organismo por diferentes gases. Nota que el líquido empleado para atrapar
efecto de la rápida combustión de sus reservas energéticas. el gas producido en la reacción puede ser agua o mercurio,
dependiendo de si el gas en cuestión es soluble o no en agua.
© Santillana 149
QUIM10-U4(146-171).indd 149 1/12/09 14:15