Page 770 - Quimica - Undécima Edición
P. 770
740 CAPÍTULO 16 Equilibrios ácido-base y equilibrios de solubilidad
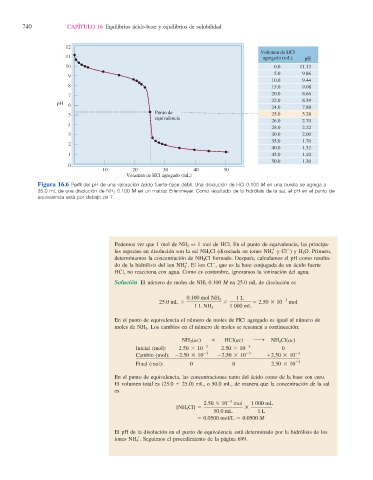
12
Volumen de HCl
11 agregado (mL) pH
10 0.0 11.13
5.0 9.86
9
10.0 9.44
8 15.0 9.08
7 20.0 8.66
22.0 8.39
pH
6
24.0 7.88
Punto de
5 25.0 5.28
equivalencia
26.0 2.70
4
28.0 2.22
3 30.0 2.00
35.0 1.70
2
40.0 1.52
1 45.0 1.40
50.0 1.30
0
10 20 30 40 50
Volumen de HCl agregado (mL)
Figura 16.6 Perfi l del pH de una valoración ácido fuerte-base débil . Una disolución de HCl 0.100 M en una bureta se agrega a
25.0 mL de una disolución de NH 3 0.100 M en un matraz Erlenmeyer. Como resultado de la hidrólisis de la sal, el pH en el punto de
equivalencia está por debajo de 7.
Podemos ver que 1 mol de NH 3 1 mol de HCl. En el punto de equivalencia, las principa-
1
2
les especies en disolución son la sal NH 4 Cl (disociada en iones NH 4 y Cl ) y H 2 O. Primero,
determinamos la concentración de NH 4 Cl formado. Después, calculamos el pH como resulta-
2
1
do de la hidrólisis del ion NH 4 . El ion Cl , que es la base conjugada de un ácido fuerte
HCl, no reacciona con agua. Como es costumbre, ignoramos la ionización del agua.
Solución El número de moles de NH 3 0.100 M en 25.0 mL de disolución es
0.100 mol NH 3 1 L 23
25.0 mL 3 3 5 2.50 3 10 mol
1 L NH 3 1 000 mL
En el punto de equivalencia el número de moles de HCl agregado es igual al número de
moles de NH 3 . Los cambios en el número de moles se resumen a continuación:
NH 3 (ac) 1 HCl(ac) ¡ NH 4 Cl(ac)
23
Inicial (mol): 2.50 3 10 2.50 3 10 23 0
23
Cambio (mol): 22.50 3 10 22.50 3 10 23 12.50 3 10 23
Final (mol): 0 0 2.50 3 10 23
En el punto de equivalencia, las concentraciones tanto del ácido como de la base son cero.
El volumen total es (25.0 1 25.0) mL, o 50.0 mL, de manera que la concentración de la sal
es
23
2.50 3 10 mol 1 000 mL
[ N H 4 Cl] 5 3
50.0 mL 1 L
5 0.0500 mol/L 5 0.0500 M
El pH de la disolución en el punto de equivalencia está determinado por la hidrólisis de los
1
iones NH 4 . Seguimos el procedimiento de la página 699.