Page 718 - Quimica - Undécima Edición
P. 718
688 CAPÍTULO 15 Ácidos y bases
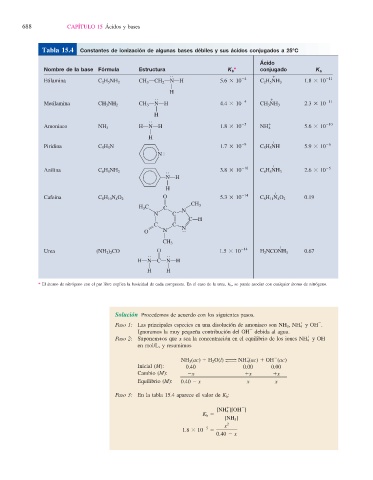
Tabla 15.4 Constantes de ionización de algunas bases débiles y sus ácidos conjugados a 25°C
Ácido
Nombre de la base Fórmula Estructura K b * conjugado K a
1
O
Etilamina C 2 H 5 NH 2 CH 3 OCH 2 ONOH 5.6 3 10 24 C 2 H 5 NH 3 1.8 3 10 211
A
H
1
O
Metilamina CH 3 NH 2 CH 3 ONOH 4.4 3 10 24 CH 3 NH 3 2.3 3 10 211
A
H
O
Amoniaco NH 3 HONOH 1.8 3 10 25 NH 4 1 5.6 3 10 210
A
H
1 26
29
Piridina C 5 H 5 N 1.7 3 10 C 5 H 5 NH 5.9 3 10
NS
1 25
210
Anilina C 6 H 5 NH 2 3.8 3 10 C 6 H 5 NH 3 2.6 3 10
O
ONOH
A
H
1
Cafeína C 8 H 10 N 4 O 2 O 5.3 3 10 214 C 8 H 11 N 4 O 2 0.19
B CH 3
H 3 C C E
N C
H E H N N
COH
B
A
C C
N
K H E Q
O N
A
CH 3
1
Urea (NH 2 ) 2 CO O 1.5 3 10 214 H 2 NCONH 3 0.67
O
O
B
HONOCONOH
A A
H H
* El átomo de nitrógeno con el par libre explica la basicidad de cada compuesto. En el caso de la urea, K b , se puede asociar con cualquier átomo de nitrógeno.
Solución Procedemos de acuerdo con los siguientes pasos.
1 2
Paso 1: Las principales especies en una disolución de amoniaco son NH 3 , NH 4 y OH .
2
Ignoramos la muy pequeña contribución del OH debida al agua.
1 2
Paso 2: Suponem+os que x sea la concentración en el equilibrio de los iones NH 4 y OH
en mol/L, y resumimos
NH 3 (ac) H 2 O(l) 34 NH 4 (ac) OH (ac)
Inicial (M): 0.40 0.00 0.00
Cambio (M): x x x
Equilibrio (M): 0.40 x x x
Paso 3: En la tabla 15.4 aparece el valor de K b :
1
2
[NH 4 ][OH ]
K b 5
[NH 3 ]
x 2
8 . 1 3 10 25 5
0.40 2 x