Page 722 - Quimica - Undécima Edición
P. 722
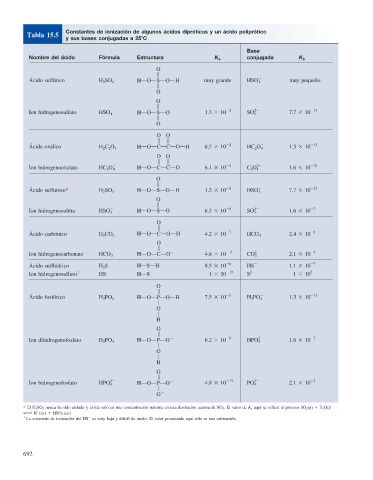
Constantes de ionización de algunos ácidos dipróticos y un ácido poliprótico
Tabla 15.5
y sus bases conjugadas a 25 C
Base
Nombre del ácido Fórmula Estructura K a conjugada K b
O
B
Ácido sulfúrico H 2 SO 4 HOOOSOOOH muy grande HSO 4 2 muy pequeño
B
O
O
B
2
Ion hidrogenosulfato HSO 4 HOOOSOO 1.3 3 10 22 SO 4 22 7.7 3 10 213
B
O
O O
B B
Ácido oxálico H 2 C 2 O 4 HOOOCOCOOOH 6.5 3 10 22 HC 2 O 4 2 1.5 3 10 213
O O
B B
2
Ion hidrogenooxalato HC 2 O 4 HOOOCOCOO 6.1 3 10 25 C 2 O 4 22 1.6 3 10 210
O
B
Ácido sulfuroso* H 2 SO 3 HOOOSOOOH 1.3 3 10 22 HSO 3 2 7.7 3 10 213
O
B
2
Ion hidrogenosulfi to HSO 3 HOOOSOO 6.3 3 10 28 SO 3 22 1.6 3 10 27
O
B
Ácido carbónico H 2 CO 3 HOOOCOOOH 4.2 3 10 27 HCO 3 2 2.4 3 10 28
O
B 211 22 24
2
Ion hidrogenocarbonato HCO 3 HOOOCOO 4.8 3 10 CO 3 2.1 3 10
Ácido sulfhídrico H 2 S HOSOH 9.5 3 10 28 HS 2 1.1 3 10 27
Ion hidrogenosulfuro † HS 2 HOS 2 1 3 10 219 S 22 1 3 10 5
O
B 23 2 212
Ácido fosfórico H 3 PO 4 HOOOPOOOH 7.5 3 10 H 2 PO 4 1.3 3 10
A
O
A
H
O
B
Ion dihidrogenofosfato H 2 PO 4 2 HOOOPOO 6.2 3 10 28 HPO 4 22 1.6 3 10 27
A
O
A
H
O
B 213 32 22
22
Ion hidrogenofosfato HPO 4 HOOOPOO 4.8 3 10 PO 4 2.1 3 10
A
O
* El H 2 SO 3 nunca ha sido aislado y existe sólo en una concentración mínima en una disolución acuosa de SO 2 . El valor de K a aquí se refi ere al proceso SO 2 (g) 1 H 2 O(l)
2
1
Δ H (ac) 1 HSO 3 (ac)
† 2
La constante de ionización del HS es muy baja y difícil de medir. El valor presentado aquí sólo es una estimación.
692