Page 656 - Quimica - Undécima Edición
P. 656
s s
s
626 CAPÍTULO 14 Equilibrio químico
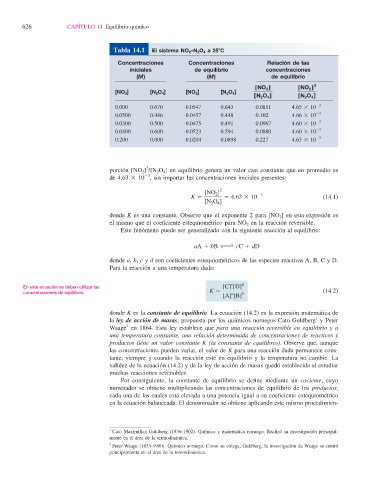
Tabla 14.1 El sistema NO 2 –N 2 O 4 a 258C
Concentraciones Concentraciones Relación de las
iniciales de equilibrio concentraciones
(M) (M) de equilibrio
[NO 2 ] [NO 2 ] 2
[NO 2 ] [N 2 O 4 ] [NO 2 ] [N 2 O 4 ]
[N 2 O 4 ] [N 2 O 4 ]
0.000 0.670 0.0547 0.643 0.0851 4.65 3 10 23
0.0500 0.446 0.0457 0.448 0.102 4.66 3 10 23
0.0300 0.500 0.0475 0.491 0.0967 4.60 3 10 23
0.0400 0.600 0.0523 0.594 0.0880 4.60 3 10 23
0.200 0.000 0.0204 0.0898 0.227 4.63 3 10 23
2
porción [NO 2 ] /[N 2 O 4 ] en equilibrio genera un valor casi constante que en promedio es
23
de 4.63 3 10 , sin importar las concentraciones iniciales presentes:
[NO 2 ] 2
K 5 5 4.63 3 10 23 (14.1)
[N 2 O 4 ]
donde K es una constante. Observe que el exponente 2 para [NO 2 ] en esta expresión es
el mismo que el coefi ciente estequiométrico para NO 2 en la reacción reversible.
Este fenómeno puede ser generalizado con la siguiente reacción al equilibrio:
aA 1 bB Δ cC 1 dD
donde a, b, c y d son coefi cientes estequiométricos de las especies reactivas A, B, C y D.
Para la reacción a una temperatura dada:
c
En esta ecuación se deben utilizar las [C] [D] d
concentraciones de equilibrio. K 5 a b 1 ( ) 2 . 4
[A] [B]
donde K es la constante de equilibrio . La ecuación (14.2) es la expresión matemática de
1
la ley de acción de masas , propuesta por los químicos noruegos Cato Guldberg y Peter
2
Waage en 1864. Esta ley establece que para una reacción reversible en equilibrio y a
una temperatura constante, una relación determinada de concentraciones de reactivos y
productos tiene un valor constante K (la constante de equilibrio). Observe que, aunque
las concentraciones pueden variar, el valor de K para una reacción dada permanece cons-
tante, siempre y cuando la reacción esté en equilibrio y la temperatura no cambie. La
validez de la ecuación (14.2) y de la ley de acción de masas quedó establecida al estudiar
muchas reacciones reversibles.
Por consiguiente, la constante de equilibrio se defi ne mediante un cociente, cuyo
numerador se obtiene multiplicando las concentraciones de equilibrio de los productos,
cada una de las cuales está elevada a una potencia igual a su coefi ciente estequiométrico
en la ecuación balanceada. El denominador se obtiene aplicando este mismo procedimien-
1
Cato Maximilian Guldberg (1836-1902). Químico y matemático noruego. Realizó su investigación principal-
mente en el área de la termodinámica.
2
Peter Waage (1833-1900). Químico noruego. Como su colega, Guldberg, la investigación de Waage se centró
principalmente en el área de la termodinámica.