Page 241 - Quimica - Undécima Edición
P. 241
5.8 Desviación del comportamiento ideal 211
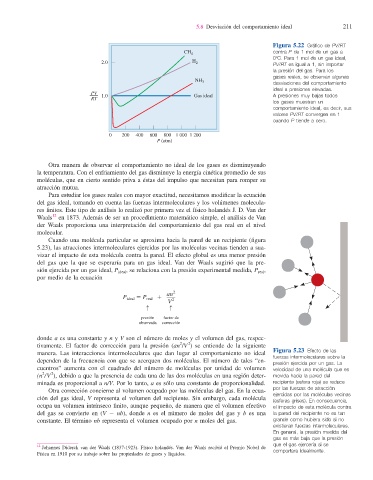
Figura 5.22 Gráfi co de PV/RT
contra P de 1 mol de un gas a
CH 4
08C. Para 1 mol de un gas ideal,
2.0 H 2
PV/RT es igual a 1, sin importar
la presión del gas. Para los
gases reales, se observan algunas
NH 3 desviaciones del comportamiento
ideal a presiones elevadas.
PV Gas ideal A presiones muy bajas todos
RT 1.0
los gases muestran un
comportamiento ideal, es decir, sus
valores PV/RT convergen en 1
cuando P tiende a cero.
0 200 400 600 800 1 000 1 200
P (atm)
Otra manera de observar el comportamiento no ideal de los gases es disminuyendo
la temperatura. Con el enfriamiento del gas disminuye la energía cinética promedio de sus
moléculas, que en cierto sentido priva a éstas del impulso que necesitan para romper su
atracción mutua.
Para estudiar los gases reales con mayor exactitud, necesitamos modifi car la ecuación
del gas ideal, tomando en cuenta las fuerzas intermoleculares y los volúmenes molecula-
res fi nitos. Este tipo de análisis lo realizó por primera vez el físico holandés J. D. Van der
12
Waals en 1873. Además de ser un procedimiento matemático simple, el análisis de Van
der Waals proporciona una interpretación del comportamiento del gas real en el nivel
molecular.
Cuando una molécula particular se aproxima hacia la pared de un recipiente (fi gura
5.23), las atracciones intermoleculares ejercidas por las moléculas vecinas tienden a sua-
vizar el impacto de esta molécula contra la pared. El efecto global es una menor presión
del gas que la que se esperaría para un gas ideal. Van der Waals sugirió que la pre-
sión ejercida por un gas ideal, P ideal , se relaciona con la presión experimental medida, P real ,
por medio de la ecuación
an 2
P ideal 5 P real 1 2
V
h h
presión factor de
observada corrección
donde a es una constante y n y V son el número de moles y el volumen del gas, respec-
2
2
tivamente. El factor de corrección para la presión (an /V ) se entiende de la siguiente
manera. Las interacciones intermoleculares que dan lugar al comportamiento no ideal Figura 5.23 Efecto de las
fuerzas intermoleculares sobre la
dependen de la frecuencia con que se acerquen dos moléculas. El número de tales “en- presión ejercida por un gas. La
cuentros” aumenta con el cuadrado del número de moléculas por unidad de volumen velocidad de una molécula que es
2
2
(n / V ), debido a que la presencia de cada una de las dos moléculas en una región deter- movida hacia la pared del
minada es proporcional a n/V. Por lo tanto, a es sólo una constante de proporcionalidad. recipiente (esfera roja) se reduce
Otra corrección concierne al volumen ocupado por las moléculas del gas. En la ecua- por las fuerzas de atracción
ejercidas por las moléculas vecinas
ción del gas ideal, V representa el volumen del recipiente. Sin embargo, cada molécula (esferas grises). En consecuencia,
ocupa un volumen intrínseco fi nito, aunque pequeño, de manera que el volumen efectivo el impacto de esta molécula contra
del gas se convierte en (V 2 nb), donde n es el número de moles del gas y b es una la pared del recipiente no es tan
constante. El término nb representa el volumen ocupado por n moles del gas. grande como hubiera sido si no
existieran fuerzas intermoleculares.
En general, la presión medida del
gas es más baja que la presión
que el gas ejercería si se
12
Johannes Diderck van der Waals (1837-1923). Físico holandés. Van der Waals recibió el Premio Nobel de
Física en 1910 por su trabajo sobre las propiedades de gases y líquidos. comportara idealmente.