Page 143 - Libro Hipertextos Quimica 2
P. 143
Componente: Procesos físicos
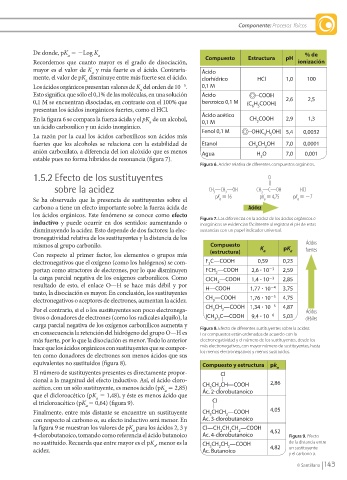
De donde, pK 5 2Log K a % de
a
Recordemos que cuanto mayor es el grado de disociación, Compuesto Estructura pH ionización
mayor es el valor de K y más fuerte es el ácido. Contraria- Ácido
a
mente, el valor de pK disminuye entre más fuerte sea el ácido. clorhídrico HCl 1,0 100
a
Los ácidos orgánicos presentan valores de K del orden de 10 . 0,1 M
25
a
Esto significa que sólo el 0,1% de las moléculas, en una solución Ácido COOH
0,1 M se encuentran disociadas, en contraste con el 100% que benzoico 0,1 M (C H COOH) 2,6 2,5
presentan los ácidos inorgánicos fuertes, como el HCl. 6 5
Ácido acético
En la figura 6 se compara la fuerza ácida y el pK de un alcohol, 0,1 M CH COOH 2,9 1,3
3
a
un ácido carboxílico y un ácido inorgánico. Fenol 0,1 M OH(C H OH) 5,4 0,0032
La razón por la cual los ácidos carboxílicos son ácidos más 6 5
fuertes que los alcoholes se relaciona con la estabilidad de Etanol CH CH OH 7,0 0,0001
3
2
anión carboxilato, a diferencia del ion alcóxido que es menos Agua H O 7,0 0,001
estable pues no forma híbridos de resonancia (figura 7). 2
Figura 6. Acidez relativa de diferentes compuestos orgánicos.
1.5.2 Efecto de los sustituyentes O
sobre la acidez CH —CH —OH CH —C—OH HCl
3
2
3
Se ha observado que la presencia de sustituyentes sobre el pK 5 16 pK 5 4,75 pK 5 27
a
a
a
carbono a tiene un efecto importante sobre la fuerza ácida de Acidez
los ácidos orgánicos. Este fenómeno se conoce como efecto Figura 7. Las diferencias en la acidez de los ácidos orgánicos e
inductivo y puede ocurrir en dos sentidos: aumentando o inorgánicos se evidencian fácilmente al registrar el pH de estas
disminuyendo la acidez. Esto depende de dos factores: la elec- sustancias con un papel indicador universal.
tronegatividad relativa de los sustituyentes y la distancia de los
mismos al grupo carbonilo. Compuesto K pK Ácidos
fuertes
Con respecto al primer factor, los elementos o grupos más (estructura) a a
electronegativos que el oxígeno (como los halógenos) se com- F C—COOH 0,59 0,23
3
portan como atractores de electrones, por lo que disminuyen FCH —COOH 2,6 ? 10 23 2,59
2
la carga parcial negativa de los oxígenos carbonílicos. Como ClCH —COOH 1,4 ? 10 23 2,85
2
resultado de esto, el enlace O—H se hace más débil y por H—COOH 1,77 ? 10 24 3,75
tanto, la disociación es mayor. En conclusión, los sustituyentes
electronegativos o aceptores de electrones, aumentan la acidez. CH —COOH 1,76 ? 10 25 4,75
3
Por el contrario, si el o los sustituyentes son poco electronega- CH CH —COOH 1,34 ? 10 25 4,87 Ácidos
2
3
tivos o donadores de electrones (como los radicales alquilo), la (CH ) C—COOH 9,4 ? 10 26 5,03 débiles
3 3
carga parcial negativa de los oxígenos carbonílicos aumenta y Figura 8. Efecto de diferentes sustituyentes sobre la acidez.
en consecuencia la retención del hidrógeno del grupo O—H es Los compuestos están ordenados de acuerdo con la
más fuerte, por lo que la disociación es menor. Todo lo anterior electronegatividad y el número de los sustituyentes, desde los
hace que los ácidos orgánicos con sustituyentes que se compor- más electronegativos, con mayor número de sustituyentes, hasta
ten como donadores de electrones son menos ácidos que sus los menos electronegativos y menos sustituidos.
equivalentes no sustituidos (figura 8). Compuesto y estructura pk
El número de sustituyentes presentes es directamente propor- Cl a
cional a la magnitud del efecto inductivo. Así, el ácido cloro- 2,86
acético, con un sólo sustituyente, es menos ácido (pK 5 2,85) CH CH CH—COOH
2
3
a
Ác. 2-clorobutanoico
que el dicloroacético (pK 5 1,48), y éste es menos ácido que
a
el tricloroacético (pK 5 0,64) (figura 9). Cl
a
Finalmente, entre más distante se encuentre un sustituyente CH CHCH —COOH 4,05
2
3
con respecto al carbono a, su efecto inductivo será menor. En Ác. 3-clorobutanoico
la figura 9 se muestran los valores de pK para los ácidos 2, 3 y Cl—CH CH CH —COOH 4,52
a
2
2
2
4-clorobutanoico, tomando como referencia el ácido butanoico Ác. 4-clorobutanoico Figura 9. Efecto
no sustituido. Recuerda que entre mayor es el pK , menor es la CH CH CH —COOH de la distancia entre
a
3
2
2
acidez. Ác. Butanoico 4,82 un sustituyente
y el carbono a.
© Santillana 143
QUIM11-U5(138-165).indd 143 22/12/09 11:05