Page 260 - Libro Hipertextos Quimica 1
P. 260
Electroquímica
3.3.4 Aplicaciones de las celdas galvánicas
Retomando los conceptos expresados hasta el momento, podemos decir
que en una celda electrolítica se consume energía eléctrica para pro-
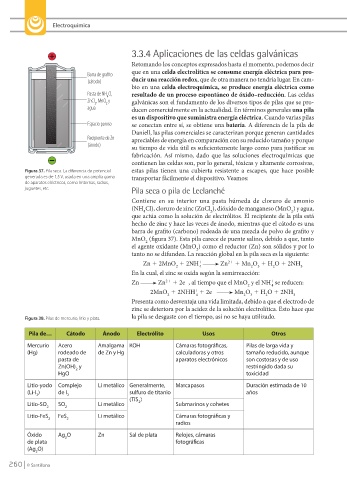
Barra de grafito
(cátodo) ducir una reacción redox, que de otra manera no tendría lugar. En cam-
bio en una celda electroquímica, se produce energía eléctrica como
Pasta de NH Cl, resultado de un proceso espontáneo de óxido–reducción. Las celdas
4
ZnCl , MnO y galvánicas son el fundamento de los diversos tipos de pilas que se pro-
2
2
agua ducen comercialmente en la actualidad. En términos generales una pila
es un dispositivo que suministra energía eléctrica. Cuando varias pilas
Espacio poroso se conectan entre sí, se obtiene una batería. A diferencia de la pila de
Daniell, las pilas comerciales se caracterizan porque generan cantidades
Recipiente de Zn apreciables de energía en comparación con su reducido tamaño y porque
(ánodo) su tiempo de vida útil es suficientemente largo como para justificar su
fabricación. Así mismo, dado que las soluciones electroquímicas que
contienen las celdas son, por lo general, tóxicas y altamente corrosivas,
Figura 37. Pila seca. La diferencia de potencial estas pilas tienen una cubierta resistente a escapes, que hace posible
generada es de 1,5 V, usada en una amplia gama transportar fácilmente el dispositivo. Veamos:
de aparatos eléctricos, como linternas, radios,
juguetes, etc. Pila seca o pila de Leclanché
Contiene en su interior una pasta húmeda de cloruro de amonio
(NH Cl), cloruro de zinc (ZnCl ), dióxido de manganeso (MnO ) y agua,
4
2
2
que actúa como la solución de electrólitos. El recipiente de la pila está
hecho de zinc y hace las veces de ánodo, mientras que el cátodo es una
barra de grafito (carbono) rodeada de una mezcla de polvo de grafito y
MnO (figura 37). Esta pila carece de puente salino, debido a que, tanto
2
el agente oxidante (MnO ) como el reductor (Zn) son sólidos y por lo
2
tanto no se difunden. La reacción global en la pila seca es la siguiente:
Zn 1 2MnO 1 2NH Zn 1 Mn O 1 H O 1 2NH 3
21
1
2
3
4
2
2
En la cual, el zinc se oxida según la semirreacción:
Zn Zn 1 2e , al tiempo que el MnO y el NH se reducen:
21
1
2
2 4
2MnO 1 2NHH 1 2e Mn O 1 H O 1 2NH
1
2
2 4 2 3 2 3
Presenta como desventaja una vida limitada, debido a que el electrodo de
zinc se deteriora por la acidez de la solución electrolítica. Esto hace que
Figura 38. Pilas de mercurio, litio y plata. la pila se desgaste con el tiempo, así no se haya utilizado.
Pila de… Cátodo Ánodo Electrólito Usos Otros
Mercurio Acero Amalgama KOH Cámaras fotográficas, Pilas de larga vida y
(Hg) rodeado de de Zn y Hg calculadoras y otros tamaño reducido, aunque
pasta de aparatos electrónicos son costosas y de uso
Zn(OH) y restringido dada su
2
HgO toxicidad
Litio-yodo Complejo Li metálico Generalmente, Marcapasos Duración estimada de 10
(Li-I ) de I 2 sulfuro de titanio años
2
(TiS )
Litio-SO SO Li metálico 2 Submarinos y cohetes
2 2
Litio-FeS 2 FeS 2 Li metálico Cámaras fotográficas y
radios
Óxido Ag O Zn Sal de plata Relojes, cámaras
2
de plata fotográficas
(Ag O)
2
260 © Santillana
QUIM10-U7(234-273).indd 260 1/12/09 18:28