Page 258 - Libro Hipertextos Quimica 1
P. 258
Electroquímica
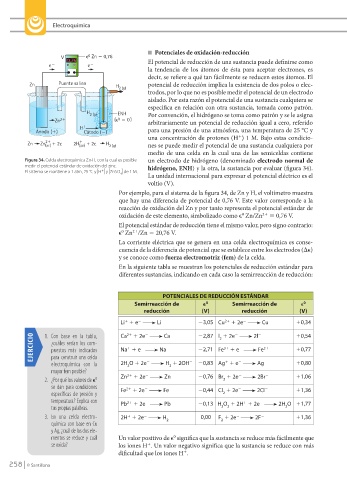
n Potenciales de oxidación-reducción
V 0 Zn 0,76
0,76 El potencial de reducción de una sustancia puede definirse como
0,76
e e
la tendencia de los átomos de ésta para aceptar electrones, es
decir, se refiere a qué tan fácilmente se reducen estos átomos. El
Zn Puente salino H potencial de reducción implica la existencia de dos polos o elec-
2 (g)
trodos, por lo que no es posible medir el potencial de un electrodo
aislado. Por esta razón el potencial de una sustancia cualquiera se
especifica en relación con otra sustancia, tomada como patrón.
H
2 (g) ENH Por convención, el hidrógeno se toma como patrón y se le asigna
Zn 2 ( 0 0 ( arbitrariamente un potencial de reducción igual a cero, referido
H para una presión de una atmósfera, una temperatura de 25 °C y
Ánodo ( ) Cátodo ( )
una concentración de protones (H ) 1 M. Bajo estas condicio-
1
2
Zn Zn (ac) 2e 2H 2e H 2 (g) nes se puede medir el potencial de una sustancia cualquiera por
(ac)
medio de una celda en la cual una de las semiceldas contiene
Figura 34. Celda electroquímica Zn-H, con la cual es posible un electrodo de hidrógeno (denominado electrodo normal de
medir el potencial estándar de oxidación del zinc. hidrógeno, ENH) y la otra, la sustancia por evaluar (figura 34).
El sistema se mantiene a 1 atm, 25 °C y 3H 4 y 3ZnSO 4 de 1 M.
1
4 La unidad internacional para expresar el potencial eléctrico es el
voltio (V).
Por ejemplo, para el sistema de la figura 34, de Zn y H, el voltímetro muestra
que hay una diferencia de potencial de 0,76 V. Este valor corresponde a la
reacción de oxidación del Zn y por tanto representa el potencial estándar de
0
oxidación de este elemento, simbolizado como e Zn/Zn 5 0,76 V.
21
El potencial estándar de reducción tiene el mismo valor, pero signo contrario:
e Zn /Zn 5 20,76 V.
0
21
La corriente eléctrica que se genera en una celda electroquímica es conse-
cuencia de la diferencia de potencial que se establece entre los electrodos (De)
y se conoce como fuerza electromotriz (fem) de la celda.
En la siguiente tabla se muestran los potenciales de reducción estándar para
diferentes sustancias, indicando en cada caso la semirreacción de reducción:
POTENCIALES DE REDUCCIÓN ESTÁNDAR
Semirreacción de e Semirreacción de e
0
0
reducción (V) reducción (V)
Li 1 e 2 Li 23,05 Cu 1 2e 2 Cu 10,34
2
2
21
1
Ca
2
21
EJERCICIO 1. Con base en la tabla, Ca 1 2e Na 22,87 I 1 2e 2 2I Fe 21 10,54
2
¿cuáles serían los com-
22,71 Fe 1 e
Na 1 e
10,77
1
puestos más indicados
2
31
para construir una celda
electroquímica con la 2H O 1 2e H 1 2OH 2 20,83 Ag 1 e Ag 10,80
2
1
2
2
2
mayor fem posible?
21
2
2
2. ¿Por qué los valores de e 0 Zn 1 2e Zn 20,76 Br 1 2e 2Br 2 11,06
2
se dan para condiciones Fe 1 2e Fe 20,44 Cl 1 2e 2Cl 2 11,36
2
21
2
específicas de presión y 2
temperatura? Explica con Pb 1 2e Pb 20,13 H O 1 2H 1 2e 2H O 11,77
2
21
2
1
tus propias palabras. 2 2 2
3. En una celda electro- 2H 1 2e H 2 0,00 F 1 2e 2F 2 11,36
2
2
1
2
química con base en Cu
y Ag, ¿cuál de los dos ele-
0
mentos se reduce y cuál Un valor positivo de e significa que la sustancia se reduce más fácilmente que
se oxida? los iones H . Un valor negativo significa que la sustancia se reduce con más
1
dificultad que los iones H .
1
258 © Santillana
QUIM10-U7(234-273).indd 258 1/12/09 18:28