Page 262 - Libro Hipertextos Quimica 1
P. 262
Electroquímica
Pilas de combustible
Un pila de combustible es una celda electroquímica en la cual se
aprovecha la energía producida durante la combustión de un com-
puesto para generar energía eléctrica. La eficiencia de la conversión
entre energía química y eléctrica es cercana al 75%, en contraste con
Cátodo Ánodo un 40% de eficiencia en la conversión de energía calórica a eléctrica,
como sucede en las plantas termoeléctricas.
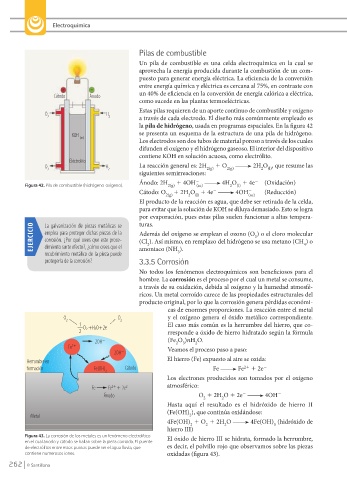
Estas pilas requieren de un aporte continuo de combustible y oxígeno
O 2 H 2 a través de cada electrodo. El diseño más comúnmente empleado es
la pila de hidrógeno, usada en programas espaciales. En la figura 42
KOH se presenta un esquema de la estructura de una pila de hidrógeno.
(ac)
Los electrodos son dos tubos de material poroso a través de los cuales
difunden el oxígeno y el hidrógeno gaseoso. El interior del dispositivo
contiene KOH en solución acuosa, como electrólito.
Eléctrolito
O H La reacción general es: 2H 1 O 2H O , que resume las
2 2 2(g) 2(g) 2 (l)
siguientes semirreaciones:
Ánodo: 2H 1 4OH 2 4H O 1 4e (Oxidación)
2
Figura 42. Pila de combustible (hidrógeno-oxígeno). 2(g) (ac) 2 (l)
Cátodo: O 1 2H O 1 4e 4OH 2 (Reducción)
2
2(g) 2 (l) (ac)
El producto de la reacción es agua, que debe ser retirada de la celda,
para evitar que la solución de KOH se diluya demasiado. Esto se logra
por evaporación, pues estas pilas suelen funcionar a altas tempera-
turas.
La galvanización de piezas metálicas se
EJERCICIO emplea para proteger dichas piezas de la Además del oxígeno se emplean el ozono (O ) o el cloro molecular
3
corrosión. ¿Por qué crees que este proce-
(Cl ). Así mismo, en remplazo del hidrógeno se usa metano (CH ) o
2
4
dimiento surte efecto?, ¿cómo crees que el
3
recubrimiento metálico de la pieza puede amoniaco (NH ).
protegerla de la corrosión? 3.3.5 Corrosión
No todos los fenómenos electroquímicos son beneficiosos para el
hombre. La corrosión es el proceso por el cual un metal se consume,
a través de su oxidación, debida al oxígeno y la humedad atmosfé-
ricos. Un metal corroído carece de las propiedades estructurales del
producto original, por lo que la corrosión genera pérdidas económi-
cas de enormes proporciones. La reacción entre el metal
O 2 O 2 y el oxígeno genera el óxido metálico correspondiente.
1 O+HO+2e 2 El caso más común es la herrumbre del hierro, que co-
2 2 2 rresponde a óxido de hierro hidratado según la fórmula
2OH 2 (Fe O )nH O.
2
3
2
Fe 21 Veamos el proceso paso a paso:
2OH 2
Herrumbre en El hierro (Fe) expuesto al aire se oxida:
21
formación Fe(OH) 2 Cátodo Fe Fe 1 2e 2
Los electrones producidos son tomados por el oxígeno
Fe Fe 1 2e 2 atmosférico:
21
2
Ánodo O 1 2H O 1 2e 4OH 2
2 2
Hasta aquí el resultado es el hidróxido de hierro II
(Fe(OH) ), que continúa oxidándose:
Metal 2
4Fe(OH) 1 O 1 2H O 4Fe(OH) (hidróxido de
3
2
2
2
hierro III)
Figura 43. La corrosión de los metales es un fenómeno electrolítico El óxido de hierro III se hidrata, formado la herrumbre,
en el cual ánodo y cátodo se hallan sobre la pieza corroída. El puente
de electrólitos entre estos puntos puede ser el agua lluvia, que es decir, el polvillo rojo que observamos sobre las piezas
contiene numerosos iones. oxidadas (figura 43).
262 © Santillana
QUIM10-U7(234-273).indd 262 1/12/09 18:28