Page 241 - Libro Hipertextos Quimica 1
P. 241
Desarrollo de competencias
1 En un cuadro comparativo, resume las caracterís-
ticas dadas a los ácidos y las bases a través de la
historia. A
2 Plantea la constante de acidez, K , para la disolu-
a
ción del ácido acético en el agua. B
CH COOH 1 H O CH COO 1 H O 1 Concentración de reactivos y productos C
2
3 2 3 3
3 Con base en la ecuación de la disolución del ácido
acético en agua y la concentración del ion hidronio D
23
[H O ] 5 1,89 3 10 M, calcula la concentración
1
3
de los iones acetato [CH COO ] y [CH COOH],
2
3
3
y el valor de la constante de acidez (K ). t e Tiempo de reacción
a
4 Explica: 7 Escribe las ecuaciones químicas para la reacción
a) ¿Cómo se diferencia un electrólito de otra de cada una de las siguientes sustancias con agua.
sustancia? a) H PO
b) ¿Qué diferencias y semejanzas existen entre un 3 2 4
electrólito débil y un electrólito fuerte? Justifica b) HSO 4
tu respuesta con ejemplos. c) HCl
5 Completa la siguiente tabla con ejemplos. d) NH 3
Electrólitos Electrólitos No electrólitos e) O 2
fuertes débiles 8 En el ejercicio anterior indica en cada caso si se
trata de un ácido o una base según lo estudiado.
9 Una solución de ácido acético está ionizada en
1,5%.
Calcula [H ] de la solución. K 5 1,8 3 10 .
25
1
a
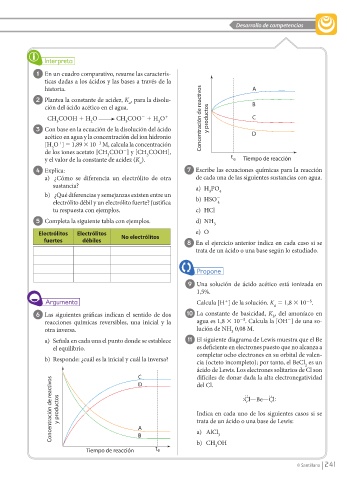
6 Las siguientes gráficas indican el sentido de dos 10 La constante de basicidad, K , del amoníaco en
b
25
2
reacciones químicas reversibles, una inicial y la agua es 1,8 3 10 . Calcula la [OH ] de una so-
otra inversa. lución de NH 0,08 M.
3
a) Señala en cada una el punto donde se establece 11 El siguiente diagrama de Lewis muestra que el Be
el equilibrio. es deficiente en electrones puesto que no alcanza a
completar ocho electrones en su orbital de valen-
b) Responde: ¿cuál es la inicial y cuál la inversa? cia (octeto incompleto); por tanto, el BeCl es un
2
ácido de Lewis. Los electrones solitarios de Cl son
difíciles de donar dada la alta electronegatividad
C
Concentración de reactivos y productos A Indica en cada uno de los siguientes casos si se
del Cl.
D
:Cl—Be—Cl:
trata de un ácido o una base de Lewis:
b) CH OH
3
Tiempo de reacción B t e a) AlCl 3
© Santillana 241
QUIM10-U7(234-273).indd 241 1/12/09 18:28