Page 804 - Quimica - Undécima Edición
P. 804
774 CAPÍTULO 16 Equilibrios ácido-base y equilibrios de solubilidad
14 14 14 14
12 12 12 12
10 10 10 10
pH 8 6 pH 8 6 pH 8 6 pH 8 6
4 4 4 4
2 2 2 2
0 0 0 0
0 10 20 30 40 0 10 20 30 40 0 10 20 30 40 0 10 20 30 40
Volumen de NaOH agregado (mL) Volumen de NaOH agregado (mL)
Volumen de HCl agregado (mL) Volumen de HCl agregado (mL)
a) b)
a) b)
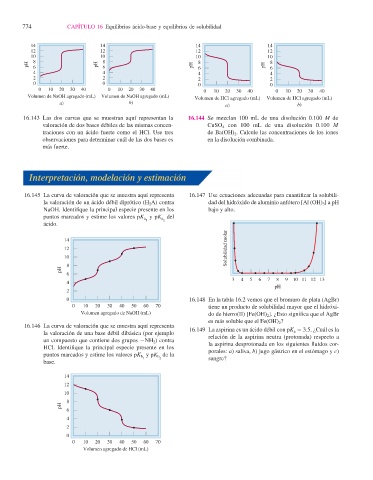
16.143 Las dos curvas que se muestran aquí representan la 16.144 Se mezclan 100 mL de una disolución 0.100 M de
valoración de dos bases débiles de las mismas concen- CuSO 4 con 100 mL de una disolución 0.100 M
traciones con un ácido fuerte como el HCl. Use tres de Ba(OH) 2 . Calcule las concentraciones de los iones
observaciones para determinar cuál de las dos bases es en la disolución combinada.
más fuerte.
Interpretación, modelación y estimación
16.145 La curva de valoración que se muestra aquí representa 16.147 Use ecuaciones adecuadas para cuantifi car la solubili-
la valoración de un ácido débil diprótico (H 2 A) contra dad del hidróxido de aluminio anfótero [Al (OH) 3 ] a pH
NaOH. Identifi que la principal especie presente en los bajo y alto.
puntos marcados y estime los valores pK a y pK a del
1 2
ácido.
Solubilidad molar
14
12
10
8
pH
6
3 4 5 6 7 8 9 10 11 12 13
4
pH
2
0 16.148 En la tabla 16.2 vemos que el bromuro de plata (AgBr)
0 10 20 30 40 50 60 70 tiene un producto de solubilidad mayor que el hidróxi-
Volumen agregado de NaOH (mL) do de hierro(II) [Fe(OH) 2 ]. ¿Esto signifi ca que el AgBr
es más soluble que el Fe(OH) 2 ?
16.146 La curva de valoración que se muestra aquí representa
la valoración de una base débil dibásica (por ejemplo 16.149 La aspirina es un ácido débil con pK a 5 3.5. ¿Cuál es la
relación de la aspirina neutra (protonada) respecto a
un compuesto que contiene dos grupos 2NH 2 ) contra
HCl. Identifi que la principal especie presente en los la aspirina desprotonada en los siguientes fl uidos cor-
porales: a) saliva, b) jugo gástrico en el estómago y c)
puntos marcados y estime los valores pK b y pK b de la
1 2 sangre?
base.
14
12
10
8
pH
6
4
2
0
0 10 20 30 40 50 60 70
Volumen agregado de HCl (mL)