Page 478 - Quimica - Undécima Edición
P. 478
448 CAPÍTULO 10 Enlace químico II: Geometría molecular e hibridación de orbitales atómicos
Orbital molecular sigma
σ
★
Molécula Interferencia destructiva de antienlace 2p
σ 2p
★
Átomo Átomo +
Energía 2p 2p
Interferencia constructiva Orbital molecular
σ 2p sigma de enlace σ 2p
+
a)
Orbital molecular pi
Molécula Interferencia destructiva de antienlace π ★
2p
π 2p
★
Átomo Átomo +
Energía 2p 2p
π 2p
+
Interferencia constructiva
Orbital molecular
pi de enlace (p )
2p
b)
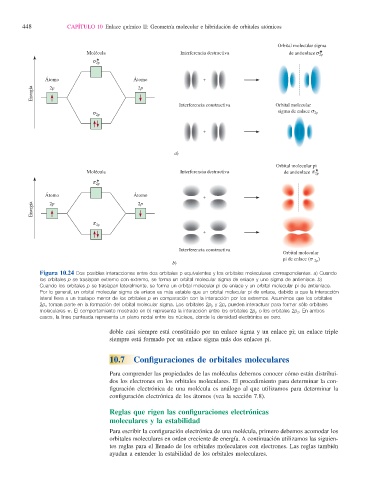
Figura 10.24 Dos posibles interacciones entre dos orbitales p equivalentes y los orbitales moleculares correspondientes. a) Cuando
los orbitales p se traslapan extremo con extremo, se forma un orbital molecular sigma de enlace y uno sigma de antienlace. b)
Cuando los orbitales p se traslapan lateralmente, se forma un orbital molecular pi de enlace y un orbital molecular pi de antienlace.
Por lo general, un orbital molecular sigma de enlace es más estable que un orbital molecular pi de enlace, debido a que la interacción
lateral lleva a un traslapo menor de los orbitales p en comparación con la interacción por los extremos. Asumimos que los orbitales
2p x toman parte en la formación del orbital molecular sigma. Los orbitales 2p y y 2p z pueden interactuar para formar sólo orbitales
moleculares p. El comportamiento mostrado en b) representa la interacción entre los orbitales 2p y o los orbitales 2p z . En ambos
casos, la línea punteada representa un plano nodal entre los núcleos, donde la densidad electrónica es cero.
doble casi siempre está constituido por un enlace sigma y un enlace pi; un enlace triple
siempre está formado por un enlace sigma más dos enlaces pi.
10.7 Confi guraciones de orbitales moleculares
Para comprender las propiedades de las moléculas debemos conocer cómo están distribui-
dos los electrones en los orbitales moleculares. El procedimiento para determinar la con-
fi guración electrónica de una molécula es análogo al que utilizamos para determinar la
confi guración electrónica de los átomos (vea la sección 7.8).
Reglas que rigen las confi guraciones electrónicas
moleculares y la estabilidad
Para escribir la confi guración electrónica de una molécula , primero debemos acomodar los
orbitales moleculares en orden creciente de energía. A continuación utilizamos las siguien-
tes reglas para el llenado de los orbitales moleculares con electrones . Las reglas también
ayudan a entender la estabilidad de los orbitales moleculares.