Page 378 - Quimica - Undécima Edición
P. 378
348 CAPÍTULO 8 Relaciones periódicas entre los elementos
Afi nidades electrónicas (kJ/mol) de algunos elementos representativos y
Tabla 8.3
de los gases nobles*
1A 2A 3A 4A 5A 6A 7A 8A
H He
73 , 0
Li Be B C N O F Ne
60 # 0 27 122 0 141 328 , 0
Na Mg Al Si P S Cl Ar
53 # 0 44 134 72 200 349 , 0
K Ca Ga Ge As Se Br Kr
48 2.4 29 118 77 195 325 , 0
Rb Sr In Sn Sb Te I Xe
47 4.7 29 121 101 190 295 , 0
Cs Ba Tl Pb Bi Po At Rn
45 14 30 110 110 ? ? , 0
* Las afi nidades electrónicas en los gases nobles, del Be y del Mg no se han determinado experimentalmente, pero se cree
que son cercanas a cero o negativas.
Existe una correlación general entre la afi nidad electrónica y la carga nuclear efectiva,
que también aumenta de izquierda a derecha en un periodo determinado (vea la página
336). Sin embargo, como en el caso de las energías de ionización, hay algunas irregula-
ridades. Por ejemplo, la afi nidad electrónica de un elemento del grupo 2A es menor que
la del elemento correspondiente del grupo 1A, y la afi nidad electrónica del elemento del
grupo 5A es menor que la del elemento correspondiente del grupo 4A. Estas excepciones
se deben a las confi guraciones de los electrones de valencia de los elementos en cuestión.
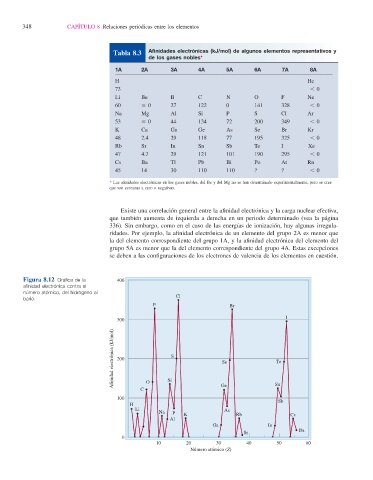
Figura 8.12 Gráfi ca de la 400
afi nidad electrónica contra el
número atómico, del hidrógeno al
bario. Cl
F Br
I
300
Afinidad electrónica (kJ/mol) 200 S Se Te
C O Si Ge Sn
100 Sb
H
Li As
Na P K Rb Cs
Al
Ga In
Ba
Sr
0
10 20 30 40 50 60
Número atómico (Z)