Page 374 - Quimica - Undécima Edición
P. 374
344 CAPÍTULO 8 Relaciones periódicas entre los elementos
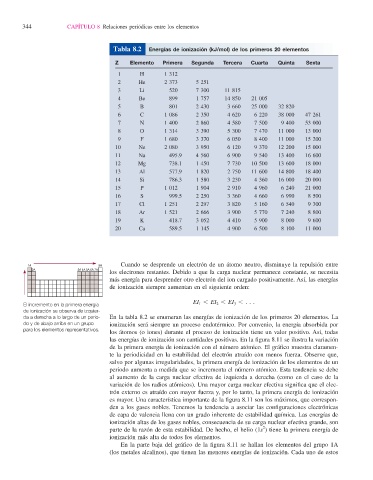
Tabla 8.2 Energías de ionización (kJ/mol) de los primeros 20 elementos
Z Elemento Primera Segunda Tercera Cuarta Quinta Sexta
1 H 1 312
2 He 2 373 5 251
3 Li 520 7 300 11 815
4 Be 899 1 757 14 850 21 005
5 B 801 2 430 3 660 25 000 32 820
6 C 1 086 2 350 4 620 6 220 38 000 47 261
7 N 1 400 2 860 4 580 7 500 9 400 53 000
8 O 1 314 3 390 5 300 7 470 11 000 13 000
9 F 1 680 3 370 6 050 8 400 11 000 15 200
10 Ne 2 080 3 950 6 120 9 370 12 200 15 000
11 Na 495.9 4 560 6 900 9 540 13 400 16 600
12 Mg 738.1 1 450 7 730 10 500 13 600 18 000
13 Al 577.9 1 820 2 750 11 600 14 800 18 400
14 Si 786.3 1 580 3 230 4 360 16 000 20 000
15 P 1 012 1 904 2 910 4 960 6 240 21 000
16 S 999.5 2 250 3 360 4 660 6 990 8 500
17 Cl 1 251 2 297 3 820 5 160 6 540 9 300
18 Ar 1 521 2 666 3 900 5 770 7 240 8 800
19 K 418.7 3 052 4 410 5 900 8 000 9 600
20 Ca 589.5 1 145 4 900 6 500 8 100 11 000
1A 8A Cuando se desprende un electrón de un átomo neutro, disminuye la repulsión entre
2A 3A 4A 5A 6A 7A
los electrones restantes. Debido a que la carga nuclear permanece constante, se necesita
más energía para desprender otro electrón del ion cargado positivamente. Así, las energías
de ionización siempre aumentan en el siguiente orden:
EI 1 , EI 2 , EI 3 , . . .
El incremento en la primera energía
de ionización se observa de izquier-
da a derecha a lo largo de un perio- En la tabla 8.2 se enumeran las energías de ionización de los primeros 20 elementos. La
do y de abajo arriba en un grupo ionización será siempre un proceso endotérmico . Por convenio, la energía absorbida por
para los elementos representativos.
los átomos (o iones) durante el proceso de ionización tiene un valor positivo. Así, todas
las energías de ionización son cantidades positivas. En la fi gura 8.11 se ilustra la variación
de la primera energía de ionización con el número atómico. El gráfi co muestra claramen-
te la periodicidad en la estabilidad del electrón atraído con menos fuerza. Observe que,
salvo por algunas irregularidades, la primera energía de ionización de los elementos de un
periodo aumenta a medida que se incrementa el número atómico. Esta tendencia se debe
al aumento de la carga nuclear efectiva de izquierda a derecha (como en el caso de la
variación de los radios atómicos). Una mayor carga nuclear efectiva signifi ca que el elec-
trón externo es atraído con mayor fuerza y, por lo tanto, la primera energía de ionización
es mayor. Una característica importante de la fi gura 8.11 son los máximos, que correspon-
den a los gases nobles. Tenemos la tendencia a asociar las confi guraciones electrónicas
de capa de valencia llena con un grado inherente de estabilidad química. Las energías de
ionización altas de los gases nobles, consecuencia de su carga nuclear efectiva grande, son
2
parte de la razón de esta estabilidad. De hecho, el helio (1s ) tiene la primera energía de
ionización más alta de todos los elementos.
En la parte baja del gráfi co de la fi gura 8.11 se hallan los elementos del grupo 1A
(los metales alcalinos), que tienen las menores energías de ionización. Cada uno de estos