Page 372 - Quimica - Undécima Edición
P. 372
342 CAPÍTULO 8 Relaciones periódicas entre los elementos
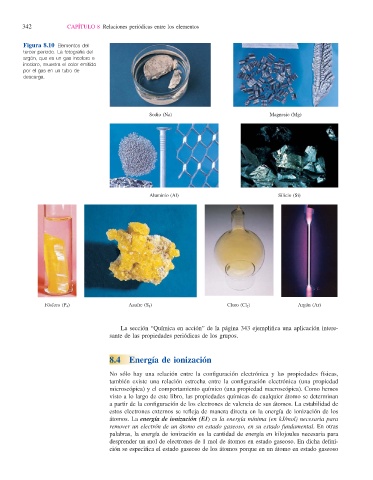
Figura 8.10 Elementos del
tercer periodo. La fotografía del
argón, que es un gas incoloro e
inodoro, muestra el color emitido
por el gas en un tubo de
descarga.
Sodio (Na) Magnesio (Mg)
Aluminio (Al) Silicio (Si)
Fósforo (P 4 ) Azufre (S 8 ) Cloro (Cl 2 ) Argón (Ar)
La sección “Química en acción” de la página 343 ejemplifi ca una aplicación intere-
sante de las propiedades periódicas de los grupos.
8.4 Energía de ionización
No sólo hay una relación entre la confi guración electrónica y las propiedades físicas,
también existe una relación estrecha entre la confi guración electrónica (una propiedad
microscópica) y el comportamiento químico (una propiedad macroscópica). Como hemos
visto a lo largo de este libro, las propiedades químicas de cualquier átomo se determinan
a partir de la confi guración de los electrones de valencia de sus átomos. La estabilidad de
estos electrones externos se refl eja de manera directa en la energía de ionización de los
átomos . La energía de ionización (EI) es la energía mínima (en kJ/mol) necesaria para
remover un electrón de un átomo en estado gaseoso, en su estado fundamental. En otras
palabras, la energía de ionización es la cantidad de energía en kilojoules necesaria para
desprender un mol de electrones de 1 mol de átomos en estado gaseoso. En dicha defi ni-
ción se especifi ca el estado gaseoso de los átomos porque en un átomo en estado gaseoso