Page 368 - Quimica - Undécima Edición
P. 368
338 CAPÍTULO 8 Relaciones periódicas entre los elementos
300
Cs
250 Rb
K
200
Na
Radio atómico (pm) 150 Li Po
Br I
100
Cl
F
50
0 10 20 30 40 50 60 70 80 90
Número atómico
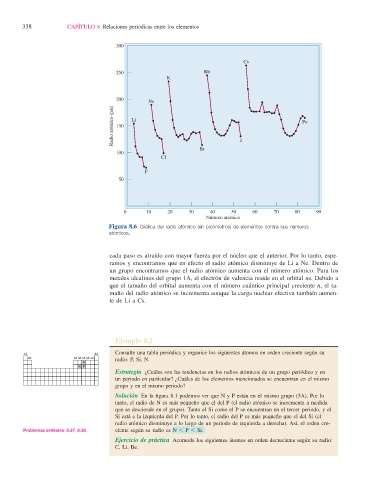
Figura 8.6 Gráfi ca del radio atómico (en picómetros) de elementos contra sus números
atómicos.
cada paso es atraído con mayor fuerza por el núcleo que el anterior. Por lo tanto, espe-
ramos y encontramos que en efecto el radio atómico disminuye de Li a Ne. Dentro de
un grupo encontramos que el radio atómico aumenta con el número atómico. Para los
metales alcalinos del grupo 1A, el electrón de valencia reside en el orbital ns. Debido a
que el tamaño del orbital aumenta con el número cuántico principal creciente n, el ta-
maño del radio atómico se incrementa aunque la carga nuclear efectiva también aumen-
te de Li a Cs.
Ejemplo 8.2
Consulte una tabla periódica y organice los siguientes átomos en orden creciente según su
1A 8A
2A 3A 4A 5A 6A 7A radio: P, Si, N.
N
Si P
Estrategia ¿Cuáles son las tendencias en los radios atómicos de un grupo periódico y en
un periodo en particular? ¿Cuáles de los elementos mencionados se encuentran en el mismo
grupo y en el mismo periodo?
Solución En la fi gura 8.1 podemos ver que N y P están en el mismo grupo (5A). Por lo
tanto, el radio de N es más pequeño que el del P (el radio atómico se incrementa a medida
que se desciende en el grupo). Tanto el Si como el P se encuentran en el tercer periodo, y el
Si está a la izquierda del P. Por lo tanto, el radio del P es más pequeño que el del Si (el
radio atómico disminuye a lo largo de un periodo de izquierda a derecha). Así, el orden cre-
Problemas similares: 8.37, 8.38. ciente según su radio es N , P , Si.
Ejercicio de práctica Acomode los siguientes átomos en orden decreciente según su radio:
C, Li, Be.