Page 363 - Quimica - Undécima Edición
P. 363
8.2 Clasifi cación periódica de los elementos 333
Zinc
Elementos
1 Cadmio 18
1A representativos Mercurio 8A
1 2 13 14 15 16 17 2
H 2A Gases nobles Lantánidos 3A 4A 5A 6A 7A He
3 4 Metales de 5 6 7 8 9 10
Li Be transición Actínidos B C N O F Ne
11 12 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
Na Mg Al Si P S Cl Ar
3B 4B 5B 6B 7B 8B 1B 2B
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
55 56 57 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
87 88 89 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118
Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg Cn
58 59 60 61 62 63 64 65 66 67 68 69 70 71
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
90 91 92 93 94 95 96 97 98 99 100 101 102 103
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
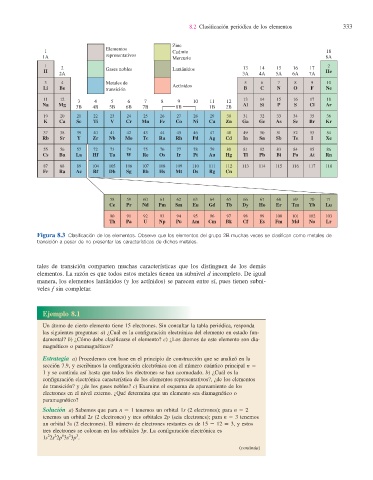
Figura 8.3 Clasifi cación de los elementos. Observe que los elementos del grupo 2B muchas veces se clasifi can como metales de
transición a pesar de no presentar las características de dichos metales.
tales de transición comparten muchas características que los distinguen de los demás
elementos. La razón es que todos estos metales tienen un subnivel d incompleto. De igual
manera, los elementos lantánidos (y los actínidos) se parecen entre sí, pues tienen subni-
veles f sin completar.
Ejemplo 8.1
Un átomo de cierto elemento tiene 15 electrones. Sin consultar la tabla periódica, responda
las siguientes preguntas: a) ¿Cuál es la confi guración electrónica del elemento en estado fun-
damental? b) ¿Cómo debe clasifi carse el elemento? c) ¿Los átomos de este elemento son dia-
magnéticos o paramagnéticos?
Estrategia a) Procedemos con base en el principio de construcción que se analizó en la
sección 7.9, y escribimos la confi guración electrónica con el número cuántico principal n 5
1 y se continúa así hasta que todos los electrones se han acomodado. b) ¿Cuál es la
confi guración electrónica característica de los elementos representativos?, ¿de los elementos
de transición? y ¿de los gases nobles? c) Examine el esquema de apareamiento de los
electrones en el nivel externo. ¿Qué determina que un elemento sea diamagnético o
paramagnético?
Solución a) Sabemos que para n 5 1 tenemos un orbital 1s (2 electrones); para n 5 2
tenemos un orbital 2s (2 electrones) y tres orbitales 2p (seis electrones); para n 5 3 tenemos
un orbital 3s (2 electrones). El número de electrones restantes es de 15 2 12 5 3, y estos
tres electrones se colocan en los orbitales 3p. La confi guración electrónica es
2
2
3
2
6
1s 2s 2p 3s 3p .
(continúa)