Page 360 - Quimica - Undécima Edición
P. 360
330 CAPÍTULO 8 Relaciones periódicas entre los elementos
Tiempos antiguos 1735-1843 1894-1918
Edad Media-1700 1843-1886 1923-1961 1965-
1 2
H He
3 4 5 6 7 8 9 10
Li Be B C N O F Ne
11 12 13 14 15 16 17 18
Na Mg Al Si P S Cl Ar
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
55 56 57 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
87 88 89 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118
Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg Cn
58 59 60 61 62 63 64 65 66 67 68 69 70 71
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
90 91 92 93 94 95 96 97 98 99 100 101 102 103
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
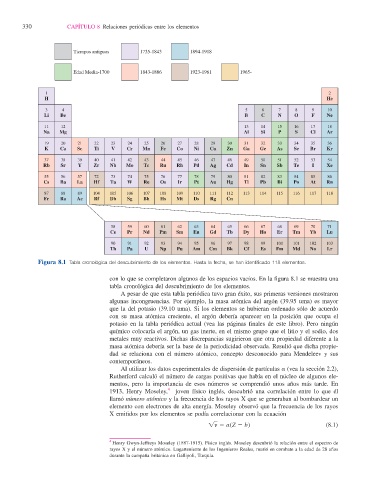
Figura 8.1 Tabla cronológica del descubrimiento de los elementos. Hasta la fecha, se han identifi cado 118 elementos.
con lo que se completaron algunos de los espacios vacíos. En la fi gura 8.1 se muestra una
tabla cronológica del descubrimiento de los elementos.
A pesar de que esta tabla periódica tuvo gran éxito, sus primeras versiones mostraron
algunas incongruencias. Por ejemplo, la masa atómica del argón (39.95 uma) es mayor
que la del potasio (39.10 uma). Si los elementos se hubieran ordenado sólo de acuerdo
con su masa atómica creciente, el argón debería aparecer en la posición que ocupa el
potasio en la tabla periódica actual (vea las páginas fi nales de este libro). Pero ningún
químico colocaría el argón, un gas inerte, en el mismo grupo que el litio y el sodio , dos
metales muy reactivos. Dichas discrepancias sugirieron que otra propiedad diferente a la
masa atómica debería ser la base de la periodicidad observada. Resultó que dicha propie-
dad se relaciona con el número atómico , concepto desconocido para Mendeleev y sus
contemporáneos.
Al utilizar los datos experimentales de dispersión de partículas a (vea la sección 2.2),
Rutherford calculó el número de cargas positivas que había en el núcleo de algunos ele-
mentos, pero la importancia de esos números se comprendió unos años más tarde. En
4
1913, Henry Moseley, joven físico inglés, descubrió una correlación entre lo que él
llamó número atómico y la frecuencia de los rayos X que se generaban al bombardear un
elemento con electrones de alta energía . Moseley observó que la frecuencia de los rayos
X emitidos por los elementos se podía correlacionar con la ecuación
1n 5 a(Z 2 b) ) 1 . 8 (
4
Henry Gwyn-Jeffreys Moseley (1887-1915). Físico inglés. Moseley descubrió la relación entre el espectro de
rayos X y el número atómico. Lugarteniente de los Ingenieros Reales, murió en combate a la edad de 28 años
durante la campaña británica en Gallipoli, Turquía.