Page 375 - Quimica - Undécima Edición
P. 375
8.4 Energía de ionización 345
2 500
He
Ne
Primera energía de ionización (kJ/mol) 1 500 H Ar Kr Xe Rn
2 000
1 000
500
Li Na
K Rb Cs
0 10 20 30 40 50 60 70 80 90
Número atómico (Z)
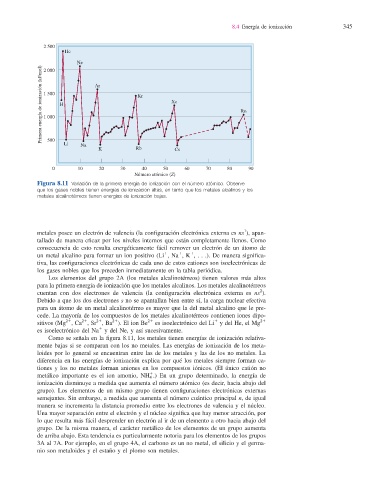
Figura 8.11 Variación de la primera energía de ionización con el número atómico. Observe
que los gases nobles tienen energías de ionización altas, en tanto que los metales alcalinos y los
metales alcalinotérreos tienen energías de ionización bajas.
1
metales posee un electrón de valencia (la confi guración electrónica externa es ns ), apan-
tallado de manera efi caz por los niveles internos que están completamente llenos. Como
consecuencia de esto resulta energéticamente fácil remover un electrón de un átomo de
1
1
1
un metal alcalino para formar un ion positivo (Li , Na , K , . . .). De manera signifi ca-
tiva, las confi guraciones electrónicas de cada uno de estos cationes son isoelectrónicas de
los gases nobles que los preceden inmediatamente en la tabla periódica.
Los elementos del grupo 2A (los metales alcalinotérreos) tienen valores más altos
para la primera energía de ionización que los metales alcalinos. Los metales alcalinotérreos
2
cuentan con dos electrones de valencia (la confi guración electrónica externa es ns ).
Debido a que los dos electrones s no se apantallan bien entre sí, la carga nuclear efectiva
para un átomo de un metal alcalinotérreo es mayor que la del metal alcalino que le pre-
cede. La mayoría de los compuestos de los metales alcalinotérreos contienen iones dipo-
21
21
21
21
21
21
1
sitivos (Mg , Ca , Sr , Ba ). El ion Be es isoelectrónico del Li y del He, el Mg
1
es isoelectrónico del Na y del Ne, y así sucesivamente.
Como se señala en la fi gura 8.11, los metales tienen energías de ionización relativa-
mente bajas si se comparan con los no metales. Las energías de ionización de los meta-
loides por lo general se encuentran entre las de los metales y las de los no metales. La
diferencia en las energías de ionización explica por qué los metales siempre forman ca-
tiones y los no metales forman aniones en los compuestos iónicos. (El único catión no
1
metálico importante es el ion amonio, NH 4 .) En un grupo determinado, la energía de
ionización disminuye a medida que aumenta el número atómico (es decir, hacia abajo del
grupo). Los elementos de un mismo grupo tienen confi guraciones electrónicas externas
semejantes. Sin embargo, a medida que aumenta el número cuántico principal n, de igual
manera se incrementa la distancia promedio entre los electrones de valencia y el núcleo.
Una mayor separación entre el electrón y el núcleo signifi ca que hay menor atracción, por
lo que resulta más fácil desprender un electrón al ir de un elemento a otro hacia abajo del
grupo. De la misma manera, el carácter metálico de los elementos de un grupo aumenta
de arriba abajo. Esta tendencia es particularmente notoria para los elementos de los grupos
3A al 7A. Por ejemplo, en el grupo 4A, el carbono es un no metal, el silicio y el germa-
nio son metaloides y el estaño y el plomo son metales.