Page 763 - Quimica - Undécima Edición
P. 763
16.4 Valoraciones ácido-base 733
14
Volumen de NaOH
13
agregado (mL) pH
12
0.0 1.00
11 5.0 1.18
10 10.0 1.37
15.0 1.60
9
20.0 1.95
8 22.0 2.20
pH
7 Punto de 24.0 2.69
equivalencia
6 25.0 7.00
26.0 11.29
5
28.0 11.75
4
30.0 11.96
3 35.0 12.22
2 40.0 12.36
45.0 12.46
1
50.0 12.52
0
10 20 30 40 50
Volumen de NaOH agregado (mL)
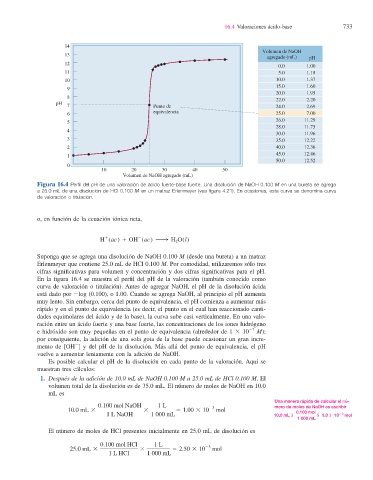
Figura 16.4 Perfi l del pH de una valoración de ácido fuerte-base fuerte. Una disolución de NaOH 0.100 M en una bureta se agrega
a 25.0 mL de una disolución de HCl 0.100 M en un matraz Erlenmeyer (vea fi gura 4.21). En ocasiones, esta curva se denomina curva
de valoración o titulación.
o, en función de la ecuación iónica neta,
1
2
H (ac) 1 OH (ac) ¡ H 2 O(l)
Suponga que se agrega una disolución de NaOH 0.100 M (desde una bureta) a un matraz
Erlenmeyer que contiene 25.0 mL de HCl 0.100 M. Por comodidad, utilizaremos sólo tres
cifras signifi cativas para volumen y concentración y dos cifras signifi cativas para el pH.
En la fi gura 16.4 se muestra el perfi l del pH de la valoración (también conocido como
curva de valoración o titulación). Antes de agregar NaOH, el pH de la disolución ácida
está dado por 2log (0.100), o 1.00. Cuando se agrega NaOH, al principio el pH aumenta
muy lento. Sin embargo, cerca del punto de equivalencia, el pH comienza a aumentar más
rápido y en el punto de equivalencia (es decir, el punto en el cual han reaccionado canti-
dades equimolares del ácido y de la base), la curva sube casi verticalmente. En una valo-
ración entre un ácido fuerte y una base fuerte , las concentraciones de los iones hidrógeno
27
e hidróxido son muy pequeñas en el punto de equivalencia (alrededor de 1 3 10 M);
por consiguiente, la adición de una sola gota de la base puede ocasionar un gran incre-
2
mento de [OH ] y del pH de la disolución. Más allá del punto de equivalencia, el pH
vuelve a aumentar lentamente con la adición de NaOH.
Es posible calcular el pH de la disolución en cada punto de la valoración. Aquí se
muestran tres cálculos:
1. Después de la adición de 10.0 mL de NaOH 0.100 M a 25.0 mL de HCl 0.100 M. El
volumen total de la disolución es de 35.0 mL. El número de moles de NaOH en 10.0
mL es
Una manera rápida de calcular el nú-
0.100 mol NaOH 1 L mero de moles de NaOH es escribir
23
10.0 mL 3 3 5 1.00 3 10 mol 0.100 mol
1 L NaOH 1 000 mL 10.0 mL 3 5 1.0 3 10 2 3 mol
1 000 mL
El número de moles de HCl presentes inicialmente en 25.0 mL de disolución es
0.100 mol HCl 1 L 23
25.0 mL 3 3 5 2.50 3 10 mol
1 L HCl 1 000 mL