Page 503 - Quimica - Undécima Edición
P. 503
11.2 Fuerzas intermoleculares 473
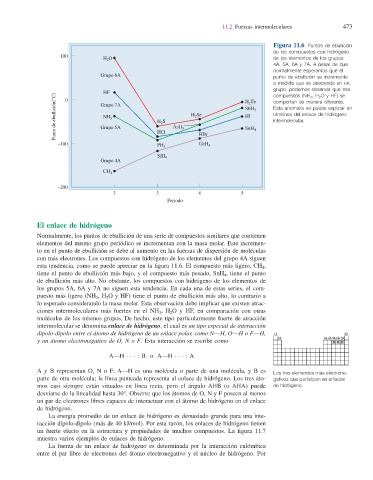
Figura 11.6 Puntos de ebullición
de los compuestos con hidrógeno
100
H O de los elementos de los grupos
2
4A, 5A, 6A y 7A. A pesar de que
normalmente esperamos que el
Grupo 6A punto de ebullición se incremente
a medida que se desciende en un
grupo, podemos observar que tres
HF H Te compuestos (NH 3 , H 2 O y HF) se
Punto de ebullición(°C) Grupo 7A H S AsH 3 H Se SbH 3 4 Esta anomalía se puede explicar en
0
comportan de manera diferente.
2
términos del enlace de hidrógeno
HI
NH
2
3
intermolecular.
2
Grupo 5A
SnH
–100 HCl 3 HBr 4
GeH
PH
SiH 4
Grupo 4A
CH 4
–200
2 3 4 5
Periodo
El enlace de hidrógeno
Normalmente, los puntos de ebullición de una serie de compuestos similares que contienen
elementos del mismo grupo periódico se incrementan con la masa molar. Este incremen-
to en el punto de ebullición se debe al aumento en las fuerzas de dispersión de moléculas
con más electrones. Los compuestos con hidrógeno de los elementos del grupo 4A siguen
esta tendencia, como se puede apreciar en la fi gura 11.6. El compuesto más ligero, CH 4 ,
tiene el punto de ebullición más bajo, y el compuesto más pesado, SnH 4 , tiene el punto
de ebullición más alto. No obstante, los compuestos con hidrógeno de los elementos de
los grupos 5A, 6A y 7A no siguen esta tendencia. En cada una de estas series, el com-
puesto más ligero (NH 3 , H 2 O y HF) tiene el punto de ebullición más alto, lo contrario a
lo esperado considerando la masa molar. Esta observación debe implicar que existen atrac-
ciones intermoleculares más fuertes en el NH 3 , H 2 O y HF, en comparación con otras
moléculas de los mismos grupos. De hecho, este tipo particularmente fuerte de atracción
intermolecular se denomina enlace de hidrógeno , el cual es un tipo especial de interacción
dipolo-dipolo entre el átomo de hidrógeno de un enlace polar, como N—H, O—H o F—H, 1A 8A
2A 3A 4A 5A 6A 7A
y un átomo electronegativo de O, N o F. Esta interacción se escribe como N O F
A—H · · · : B o A—H · · · : A
A y B representan O, N o F; A—H es una molécula o parte de una molécula, y B es Los tres elementos más electrone-
parte de otra molécula; la línea punteada representa al enlace de hidrógeno. Los tres áto- gativos que participan en enlaces
mos casi siempre están situados en línea recta, pero el ángulo AHB (o AHA) puede de hidrógeno.
desviarse de la linealidad hasta 30°. Observe que los átomos de O, N y F poseen al menos
un par de electrones libres capaces de interactuar con el átomo de hidrógeno en el enlace
de hidrógeno.
La energía promedio de un enlace de hidrógeno es demasiado grande para una inte-
racción dipolo-dipolo (más de 40 kJ/mol). Por esta razón, los enlaces de hidrógeno tienen
un fuerte efecto en la estructura y propiedades de muchos compuestos. La fi gura 11.7
muestra varios ejemplos de enlaces de hidrógeno.
La fuerza de un enlace de hidrógeno es determinada por la interacción culómbica
entre el par libre de electrones del átomo electronegativo y el núcleo de hidrógeno. Por