Page 285 - Quimica - Undécima Edición
P. 285
6.6 Entalpía estándar de formación y de reacción 255
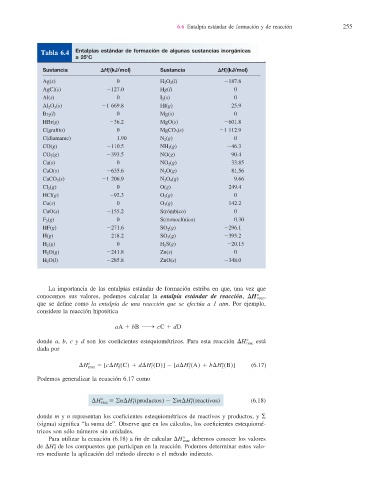
Tabla 6.4 Entalpías estándar de formación de algunas sustancias inorgánicas
a 258C
Sustancia DH8 f (kJ/mol) Sustancia DH8 f (kJ/mol)
Ag(s) 0 H 2 O 2 (l) 2187.6
AgCl(s) 2127.0 Hg(l) 0
Al(s) 0 I 2 (s) 0
Al 2 O 3 (s) 21 669.8 HI(g) 25.9
Br 2 (l) 0 Mg(s) 0
HBr(g) 236.2 MgO(s) 2601.8
C(grafi to) 0 MgCO 3 (s) 21 112.9
C(diamante) 1.90 N 2 (g) 0
CO(g) 2110.5 NH 3 (g) 246.3
CO 2 (g) 2393.5 NO(g) 90.4
Ca(s) 0 NO 2 (g) 33.85
CaO(s) 2635.6 N 2 O(g) 81.56
CaCO 3 (s) 21 206.9 N 2 O 4 (g) 9.66
Cl 2 (g) 0 O(g) 249.4
HCl(g) 292.3 O 2 (g) 0
Cu(s) 0 O 3 (g) 142.2
CuO(s) 2155.2 S(rómbico) 0
F 2 (g) 0 S(monoclínico) 0.30
HF(g) 2271.6 SO 2 (g) 2296.1
H(g) 218.2 SO 3 (g) 2395.2
H 2 (g) 0 H 2 S(g) 220.15
H 2 O(g) 2241.8 Zn(s) 0
H 2 O(l) 2285.8 ZnO(s) 2348.0
La importancia de las entalpías estándar de formación estriba en que, una vez que
conocemos sus valores, podemos calcular la entalpía estándar de reacción, DH° reac ,
que se defi ne como la entalpía de una reacción que se efectúa a 1 atm. Por ejemplo,
considere la reacción hipotética
aA 1 bB ¡ cC 1 dD
donde a, b, c y d son los coefi cientes estequiométricos. Para esta reacción DH° reac está
dada por
¢H° reac 5 [c¢H° f (C) 1 d¢H° f (D)] 2 [a¢H° f (A) 1 b¢H° f (B)] (6.17)
Podemos generalizar la ecuación 6.17 como
¢H° reac 5 on¢H° f (productos) 2 om¢H° f (reactivos) (6.18)
donde m y n representan los coefi cientes estequiométricos de reactivos y productos, y S
(sigma) signifi ca “la suma de”. Observe que en los cálculos, los coefi cientes estequiomé-
tricos son sólo números sin unidades.
Para utilizar la ecuación (6.18) a fi n de calcular DH° reac debemos conocer los valores
de DH° f de los compuestos que participan en la reacción. Podemos determinar estos valo-
res mediante la aplicación del método directo o el método indirecto.