Page 778 - Física Tippens: Conceptos y Aplicaciones, Séptima Edición Revisada
P. 778
39.2 Los elementos 759
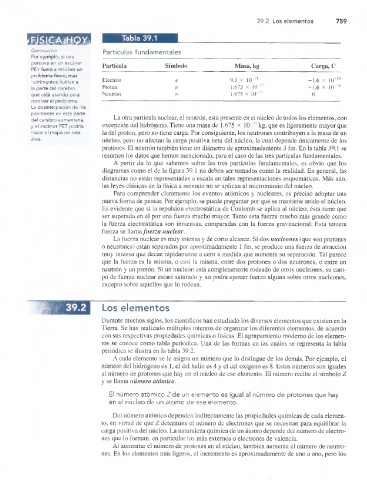
Tabla 39.1
Continuación
Partículas fundamentales
Por ejemplo, si una
persona en un escáner
Partícula Símbolo Masa, kg Carga, C
PET fuera a resolver un
problema físico, más
Electrón e 9.1 x 1(T31 -1.6 x 10“19
nutrimentos fluirían a
la parte del cerebro Protón P 1.673 X 1(T27 + 1.6 X 10“19
que está usando para Neutrón n 1.675 X 1CT27 0
resolver el problema.
La desintegración de los
positrones en esta parte
La otra partícula nuclear, el neutrón, está presente en el núcleo de todos los elementos, con
del cerebro aumentaría,
y ei escáner PET podría excepción del hidrógeno. Tiene una masa de 1.675 X 10~27 kg, que es ligeramente mayor que
trazar el mapa de esta la del protón, pero no tiene carga. Por consiguiente, los neutrones contribuyen a la masa de un
área. núcleo, pero no afectan la carga positiva neta del núcleo, la cual depende únicamente de los
protones. El neutrón también tiene un diámetro de aproximadamente 3 fm. En la tabla 39.1 se
resumen los datos que hemos mencionado, para el caso de las tres partículas fundamentales.
A partir de lo que sabemos sobre las tres partículas fundamentales, es obvio que los
diagramas como el de la figura 39.1 no deben ser tomados como la realidad. En general, las
distancias no están representadas a escala en tales representaciones esquemáticas. Más aún,
las leyes clásicas de la física a menudo no se aplican al micromundo del núcleo.
Para comprender claramente los eventos atómicos y nucleares, es preciso adoptar una
nueva forma de pensar. Por ejemplo, se puede preguntar por qué se mantiene unido el núcleo.
Es evidente que si la repulsión electrostática de Coulomb se aplica al núcleo, ésta tiene que
ser superada en él por una fuerza mucho mayor. Tanto esta fuerza mucho más grande como
la fuerza electrostática son inmensas, comparadas con la fuerza gravitacional. Esta tercera
fuerza se llama fuerza nuclear.
La fuerza nuclear es muy intensa y de corto alcance. Si dos nucleones (que son protones
o neutrones) están separados por aproximadamente 1 fm, se produce una fuerza de atracción
muy intensa que decae rápidamente a cero a medida que aumenta su separación. Tal parece
que la fuerza es la misma, o casi la misma, entre dos protones o dos neutrones, o entre un
neutrón y un protón. Si un nucleón está completamente rodeado de otros nucleones, su cam
po de fuerza nuclear estará saturado y no podrá ejercer fuerza alguna sobre otros nucleones,
excepto sobre aquellos que lo rodean.
Los elementos
Durante muchos siglos, los científicos han estudiado los diversos elementos que existen en la
Tierra. Se han realizado múltiples intentos de organizar los diferentes elementos, de acuerdo
con sus respectivas propiedades químicas o físicas. El agrupamiento moderno de los elemen
tos se conoce como tabla periódica. Una de las formas en las cuales se representa la tabla
periódica se ilustra en la tabla 39.2.
A cada elemento se le asigna un número que lo distingue de los demás. Por ejemplo, el
número del hidrógeno es 1, el del helio es 4 y el del oxígeno es 8. Estos números son iguales
al número de protones que hay en el núcleo de ese elemento. El número recibe el símbolo Z
y se llama número atómico.
El número atómico Z de un elemento es igual al número de protones que hay
en el núcleo de un átomo de ese elemento.
Del número atómico dependen indirectamente las propiedades químicas de cada elemen
to, en virtud de que Z determina el número de electrones que se necesitan para equilibrar la
carga positiva del núcleo. La naturaleza química de un átomo depende del número de electro
nes que lo forman, en particular los más externos o electrones de valencia.
Al aumentar el número de protones en el núcleo, también aumenta el número de neutro
nes. En los elementos más ligeros, el incremento es aproximadamente de uno a uno, pero los