Page 309 - Fisica General Burbano
P. 309
320 EL CALOR Y SUS EFECTOS
cia, la temperatura del cambio de estado aumenta. En el hielo y el hierro, ocurre al revés: al au-
mentar la presión, la temperatura de fusión disminuye.
El hielo funde a 0 ºC si la presión es 760 mm. Si la presión es mayor que 760 mm a menos de
0 ºC; si la presión es menor que 760 mm a más de 0 ºC.
En los lugares a mayor altura que el nivel del mar, al ser la presión menor de 760 mm, la tem-
peratura de fusión del hielo es mayor que 0 ºC. Estas variaciones de la temperatura de fusión del
hielo son prácticamente inapreciables.
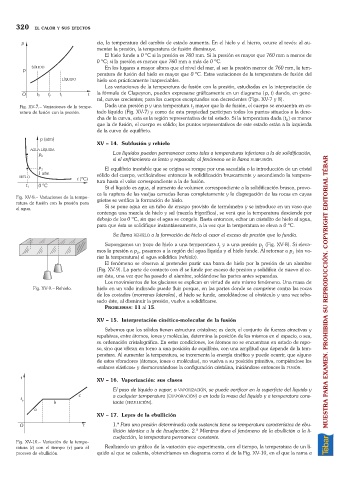
Las variaciones de la temperatura de fusión con la presión, estudiadas en la interpretación de
la fórmula de Clapeyron, pueden expresarse gráficamente en un diagrama (p, t) dando, en gene-
ral, curvas crecientes; para los cuerpos exceptuados son decrecientes (Figs. XV-7 y 8).
Fig. XV-7. Variaciones de la tempe- Dada una presión p y una temperatura t mayor que la de fusión, el cuerpo se encuentra en es-
1
ratura de fusión con la presión. tado líquido (Fig. XV-7) y como de esta propiedad participan todos los puntos situados a la dere-
cha de la curva, esta es la región representativa de tal estado. Si la temperatura dada (t ) es menor
2
que la de fusión, el cuerpo es sólido; los puntos representativos de este estado están a la izquierda
de la curva de equilibrio.
XV 14. Subfusión y rehielo
Los líquidos pueden permanecer como tales a temperaturas inferiores a la de solidificación,
si el enfriamiento es lento y reposado; al fenómeno se le llama SUBFUSIÓN.
El equilibrio inestable que se origina se rompe por una sacudida o la introducción de un cristal
sólido del cuerpo, verificándose entonces la solidificación bruscamente y ascendiendo la tempera-
tura hasta el valor correspondiente a la de fusión.
Si el líquido es agua, al aumento de volumen correspondiente a la solidificación brusca, provo-
ca la ruptura de las vasijas cerradas llenas completamente y la disgregación de las rocas en cuyas
Fig. XV-8. Variaciones de la tempe- grietas se verifica la formación de hielo.
ratura de fusión con la presión para Si se pone agua en un tubo de ensayo provisto de termómetro y se introduce en un vaso que
el agua.
contenga una mezcla de hielo y sal (mezcla frigorífica), se verá que la temperatura desciende por
debajo de los 0 ºC, sin que el agua se congele. Basta entonces, echar un cristalito de hielo al agua,
para que ésta se solidifique instantáneamente, a la vez que la temperatura se eleva a 0 ºC.
Se llama REHIELO a la formación de hielo al cesar el exceso de presión que lo fundía.
Supongamos un trozo de hielo a una temperatura t y a una presión p (Fig. XV-8). Si eleva-
1
1
mos la presión a p , pasamos a la región del agua líquida y el hielo funde. Al retornar a p (sin va-
1
2
riar la temperatura) el agua solidifica (rehielo).
El fenómeno se observa al pretender partir una barra de hielo por la presión de un alambre
(Fig. XV-9). La parte de contacto con él se funde por exceso de presión y solidifica de nuevo al ce-
sar ésta, una vez que ha pasado el alambre, soldándose las partes antes separadas.
Los movimientos de los glaciares se explican en virtud de este mismo fenómeno. Una masa de
Fig. XV-9. Rehielo. hielo en un valle inclinado puede fluir porque, en las partes donde se comprime contra las rocas
de los costados (morrenas laterales), el hielo se funde, amoldándose al obstáculo y una vez reba- MUESTRA PARA EXAMEN. PROHIBIDA SU REPRODUCCIÓN. COPYRIGHT EDITORIAL TÉBAR
sado éste, al disminuir la presión, vuelve a solidificarse.
PROBLEMAS:11 al 15.
XV 15. Interpretación cinético-molecular de la fusión
Sabemos que los sólidos tienen estructura cristalina; es decir, el conjunto de fuerzas atractivas y
repulsivas, entre átomos, iones y moléculas, determina la posición de los mismos en el espacio, o sea,
su ordenación cristalográfica. En estas condiciones, los átomos no se encuentran en estado de repo-
so, sino que vibran en torno a una posición de equilibrio, con una amplitud que depende de la tem-
peratura. Al aumentar la temperatura, se incrementa la energía cinética y puede ocurrir, que alguno
de estos vibradores (átomos, iones o moléculas), no vuelva a su posición primitiva, rompiéndose los
«enlaces elásticos» y desmoronándose la configuración cristalina, iniciándose entonces la FUSIÓN.
XV 16. Vaporización: sus clases
El paso de líquido a vapor, o VAPORIZACIÓN, se puede verificar en la superficie del líquido y
a cualquier temperatura (EVAPORACIÓN) o en toda la masa del líquido y a temperatura cons-
tante (EBULLICIÓN).
XV 17. Leyes de la ebullición
1.ª Para una presión determinada cada sustancia tiene su temperatura característica de ebu-
llición idéntica a la de licuefacción. 2.ª Mientras dura el fenómeno de la ebullición o la li-
cuefacción, la temperatura permanece constante.
Fig. XV-10. Variación de la tempe-
ratura (t) con el tiempo (t) para el Realizando un gráfico de la variación que experimenta, con el tiempo, la temperatura de un lí-
proceso de ebullición. quido al que se calienta, obtendríamos un diagrama como el de la Fig. XV-10, en el que la rama a