Page 208 - Quimica - Undécima Edición
P. 208
178 CAPÍTULO 5 Gases
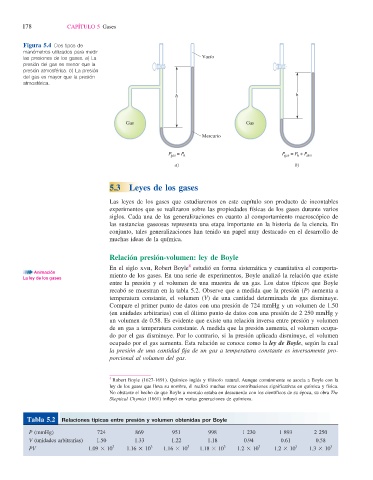
Figura 5.4 Dos tipos de
manómetros utilizados para medir
las presiones de los gases. a) La Vacío
presión del gas es menor que la
presión atmosférica. b) La presión
del gas es mayor que la presión
atmosférica.
h h
Gas Gas
Mercurio
P = P h P = P + P atm
h
gas
gas
a) b)
5.3 Leyes de los gases
Las leyes de los gases que estudiaremos en este capítulo son producto de incontables
experimentos que se realizaron sobre las propiedades físicas de los gases durante varios
siglos. Cada una de las generalizaciones en cuanto al comportamiento macroscópico de
las sustancias gaseosas representa una etapa importante en la historia de la ciencia. En
conjunto, tales generalizaciones han tenido un papel muy destacado en el desarrollo de
muchas ideas de la química.
Relación presión-volumen : ley de Boyle
4
En el siglo xvii, Robert Boyle estudió en forma sistemática y cuantitativa el comporta-
Animación
La ley de los gases miento de los gases. En una serie de experimentos, Boyle analizó la relación que existe
entre la presión y el volumen de una muestra de un gas. Los datos típicos que Boyle
recabó se muestran en la tabla 5.2. Observe que a medida que la presión (P) aumenta a
temperatura constante, el volumen (V) de una cantidad determinada de gas disminuye.
Compare el primer punto de datos con una presión de 724 mmHg y un volumen de 1.50
(en unidades arbitrarias) con el último punto de datos con una presión de 2 250 mmHg y
un volumen de 0.58. Es evidente que existe una relación inversa entre presión y volumen
de un gas a temperatura constante. A medida que la presión aumenta, el volumen ocupa-
do por el gas disminuye. Por lo contrario, si la presión aplicada disminuye, el volumen
ocupado por el gas aumenta. Esta relación se conoce como la ley de Boyle , según la cual
la presión de una cantidad fi ja de un gas a temperatura constante es inversamente pro-
porcional al volumen del gas.
4
Robert Boyle (1627-1691). Químico inglés y fi lósofo natural. Aunque comúnmente se asocia a Boyle con la
ley de los gases que lleva su nombre, él realizó muchas otras contribuciones signifi cativas en química y física.
No obstante el hecho de que Boyle a menudo estaba en desacuerdo con los científi cos de su época, su obra The
Skeptical Chymist (1661) infl uyó en varias generaciones de químicos.
Tabla 5.2 Relaciones típicas entre presión y volumen obtenidas por Boyle
P (mmHg) 724 869 951 998 1 230 1 893 2 250
V (unidades arbitrarias) 1.50 1.33 1.22 1.18 0.94 0.61 0.58
PV 1.09 3 10 3 1.16 3 10 3 1.16 3 10 3 1.18 3 10 3 1.2 3 10 3 1.2 3 10 3 1.3 3 10 3