Page 379 - Física Tippens: Conceptos y Aplicaciones, Séptima Edición Revisada
P. 379
360 Capítulo 17 Cantidad de calor
Tabla 17.2
Calores de fusión y calores de vaporización de diversas sustancias
Calor de Calor de
Punto de fusión Punto de vaporización
fusión --------------------------- ebullición ----------------------
Sustancia °C J/kg cal/g °C J/kg cal/g
Alcohol etílico -1 1 7 .3 104 X 103 24.9 78.5 854 X 103 204
Amoniaco -7 5 452 X 103 108.1 -3 3 .3 1370 X 103 327
Cobre 1080 134 X 103 32 2870 4730 X 103 1130
Helio -2 6 9 .6 5.23 X 103 1.25 -2 6 8 .9 20.9 X 103 5
Plomo 327.3 24.5 X 103 5.86 1620 871 X 103 208
Mercurio - 3 9 11.5 X 103 2.8 358 296 X 103 71
Oxígeno -2 1 8 .8 13.9 X 103 3.3 -1 8 3 213 X 103 51
Plata 960.8 88.3 X 103 21 2193 2340 X 103 558
Agua 0 334 X 103 80 100 2256 X 103 540
Cinc 420 100 X 103 24 918 1990 X 103 475
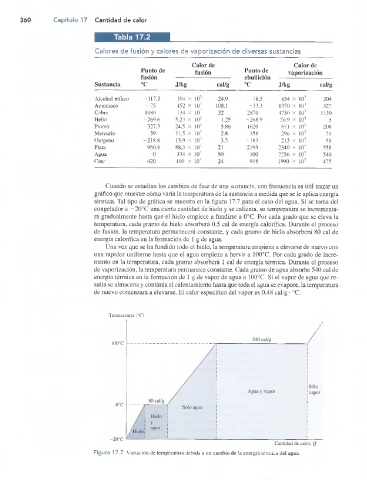
Cuando se estudian los cambios de fase de una sustancia, con frecuencia es útil trazar un
gráfico que muestre cómo varía la temperatura de la sustancia a medida que se le aplica energía
térmica. Tal tipo de gráfica se muestra en la figura 17.7 para el caso del agua. Si se toma del
congelador a — 20°C una cierta cantidad de hielo y se calienta, su temperatura se incrementa
rá gradualmente hasta que el hielo empiece a fundirse a 0°C. Por cada grado que se eleva la
temperatura, cada gramo de hielo absorberá 0.5 cal de energía calorífica. Durante el proceso
de fusión, la temperatura permanecerá constante, y cada gramo de hielo absorberá 80 cal de
energía calorífica en la formación de 1 g de agua.
Una vez que se ha fundido todo el hielo, la temperatura empieza a elevarse de nuevo con
una rapidez uniforme hasta que el agua empieza a hervir a 100°C. Por cada grado de incre
mento en la temperatura, cada gramo absorberá 1 cal de energía térmica. Durante el proceso
de vaporización, la temperatura permanece constante. Cada gramo de agua absorbe 540 cal de
energía térmica en la formación de 1 g de vapor de agua a 100°C. Si el vapor de agua que re
sulta se almacena y continúa el calentamiento hasta que toda el agua se evapore, la temperatura
de nuevo comenzará a elevarse. El calor específico del vapor es 0.48 cal/g • °C.
Temperatura (°C)
Figura 17.7 Variación de temperatura debida a un cambio de la energía térmica del agua.